
題目列表(包括答案和解析)
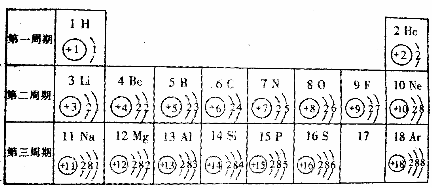
67.(09樂山)元素周期律是學習和研究化學的重要工具。下表是元素周期表的部分信息:
|
1H 氫 |
1H 氫 |
2He 氦 |
||||||
|
3Li 鋰 |
4Be 鈹 |
|
5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 |
|
llNa 鈉 |
12Mg 鎂 |
|
13A1 鋁 |
14Si 硅 |
15P 磷 |
16S 硫 |
17C1 氯 |
18Ar 氬 |
|
19K 鉀 |
20Ca 鈣 |
…… |
|
|
|
|
|
|
認真分析信息,回答:
(1)地殼中含量最多的金屬元素的符號是 ;

(2) 表示的是(填名稱) ;
(3)由2、8、12號元素組成化合物的化學式 .
(4)上表中每一周期元素原子序數的變化規律是 。
答案:(1)Al;(2)氯離子;(3)Mg(OH)2;(4)從左到右原子序數依次增大。
66.(09宜賓)用“分子”、“原子”或“離子”填空。
水由水 構成;氯化鈉溶液中含有鈉 ;化學變化中的最小粒子是 。
答案:分子 離子 原子
65.(09眉山)化學是研究物質的結構、性質以及變化規律的科學,研究元素知識是學好化學的基礎。下表包含部分元素的相關信息,完成以下填空:
(1)1869年,科學家 發現了元素周期律和元素周期表。
(2)請畫出17號元素原子結構示意圖 ,該元素在化學反應中比較容易 (填“得到”或“失去”)電子變成離子。
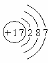 (3)上表中最活潑的金屬元素與地殼中含量最多的元素組成的化合物是
(3)上表中最活潑的金屬元素與地殼中含量最多的元素組成的化合物是
(填化學式)。
答案:(1)門捷列夫 (2) 得到 (3)Na2O(Na2O2)
64.(09湘潭)下圖①、②是氧元素、鈣元素在元素周期表中的信息,A、B、C、D是四種粒子的結構示意圖。
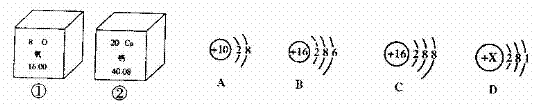
⑴氧元素的相對原子質量為_________,鈣元素的原子序數(即質子數)為________;
⑵D中的X=________;
⑶以上A、B、C、D粒子結構示意圖中,表示稀有氣體元素的原子的是________;
⑷B和______屬于同種元素的粒子(用“A”、“C”、“D”填空)。
答案:16 20 11 A C
63.(09婁底)元素周期表是學習和研究化學的重要工具。下表是元素周期表中的一部分,請按表中信息填空:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
2 |
3 Li 鋰 6.941 |
4 Be 鈹 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 9.00 |
10Ne 氖 20.18 |
|
3 |
11Na 鈉 22.99 |
12Mg 鎂 24.31 |
13 Al 鋁 6.98 |
14 Si 硅 8.09 |
15 P 磷 0.97 |
16 S 硫 2.06 |
17 Cl 氯 5.45 |
18 Ar 氬 39.95 |
(1)查找出原子序數為10的元素名稱 25 ,其相對原子質量 26 。
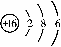
(2)硫元素的原子結構示意圖為 .該元素的原子核外有 27 個電
子層,它屬于 28 元素(填“金屬”、“非金屬”),其化學性質比較活潑,在化學反應中易 29 (填“得”、“失”)電子。
答案:25 氖 26. 20.18 27 3 28. 非金屬 29. 得
62.(09南通)(1)歷史上,道爾頓認為,原子是一個個簡單的、不可分割的實心球體。現在你認為該觀點 ▲ (選填“正確”或“錯誤”)。
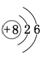

|
示意圖分別表示為:
右圖是元素周期表的一部分(數字表示相應元
素的原子序數),請用元素符號將兩種元素填入表中相應位置。
(3)上表中硫元素的每個原子需要得到 ▲ 個電子形成相對穩定結構的離子,該離子與Na+形成化合物的化學式為 ▲ 。
(4)亞氯酸鈉(NaClO2)是一種重要的消毒劑,其中氯元素的化合價為 ▲ 。
答案:(1)錯誤 (2)O Al (3)2 Na2S (4)+3 每空1分
61.(09南京)從20世紀中葉開始,硅成了信息技術的關鍵材料,是目前應用最多的半導體材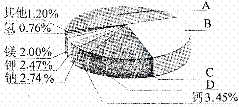 料。請回答-下列問題:
料。請回答-下列問題:
(1)地殼里各種元素的含量(質量分數)如右圖所示,其中表示硅元素的是 (填字母)。
(2)根據元素周期表可知,原子序數為6的碳原子和原子序數為14的硅原子最外層電子數均為4,則常溫下硅的化學性質 (選瑣“活潑”、“不活潑”)。
(3)制備硅半導體材料必須先得到高純硅,三氯甲硅烷(SiHCl3)還原法是當前制備高純硅的主要方法.生產過程示意如下:
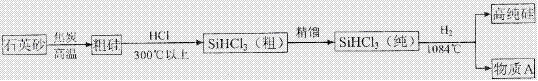
①整個制備過程必須達到無水無氧。在H2還原SiHCl3過程中若混入O2 ,可能引起的后果是 。
②在生產過程中物質A可循環使用,A的化學式是 ;在生產過程中還有一種可循環使用的物質是 。
答案:(1)B (2)不活潑 (3)①硅被氧化得不到高純硅 引起爆炸 ②HCl 氫氣(H2)
60.(09孝感)元素的化學性質主要與原子的 有關;化學變化中不能再分的粒子是 ;地殼中含量最多的元素與空氣中含量最多的元素組成的化合物的化學式為 ,其中顯正價的元素的化合價為 價。
答案:核外最外層電子數 原子 NO(或NO2……) +2(或+4……)
59.(09宜昌)下圖是構成純凈物的粒子間的關系圖。請在A、B處填入物質的化學式,C、D處填入粒子名稱(填分子、原子或離子)。
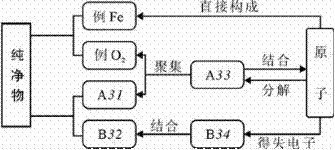
答案:31:CO2或H2O等(只要是分子構成的化合物的化學式均可)32:NaCl(只要是離子構成的化合物的化學式均可)33:分子; 34:離子
58.(09恩施)元素周期表是學習化學的重要工具。下面是元素周期表中1~18號元素原子核外電子排布,我們對它進行研究:
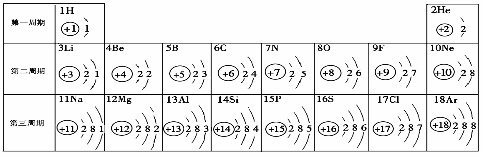
⑴ 第16號元素屬于_______元素(填“金屬”或“非金屬”),它在化學反應中容易________(填“得”或“失”)電子;
⑵ 元素的化學性質與原子結構中的______________數關系密切;
⑶ 在同一族中,各元素的原子結構呈現的規律有________________ (任寫一點);
⑷ 研究表明:第二周期從3~9號元素的原子電子層數相同,核電荷數逐漸增大,核對核外電子的引力逐漸增大,故原子半徑逐漸減小。我分析第三周期從11~17號元素原子半徑變化規律是 _________________________________。
答案:⑴ 非金屬 ;得 ;⑵ 最外層電子 ;⑶ 電子層數遞增或最外層電子數相等或從上到下核電荷數增大等(只要合理均可)⑷ 逐漸減小
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com