
【題目】碳酸鎂晶須是一種新型吸波隱形材料中的增強劑。某工廠以MgCl2(含少量雜質FeCl2、FeCl3)為原料制備碳酸鎂晶須(MgCO3·H2O)的工藝流程如下:

已知:Fe3+、Fe2+、Mg2+生成氫氧化物沉淀時的pH
物質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
注:Fe(OH)2沉淀呈絮狀,不易從溶液中除去。
(1)寫出“氧化”過程中發生的離子反應方程式并用單線橋標出電子轉移的方向和數目 。
(2)pH調節的范圍 ,濾渣的主要成分 (填化學式)。
(3)操作X包括過濾、洗滌、烘干,證明碳酸鎂晶須已經洗滌干凈的方法 。
(4)水浸后溶液中Fe2+、Fe3+含量的測定
①取水浸后溶液100.00 mL,測得Cl的濃度為0.455 mol·L1,向其中緩緩通入氯氣使Fe2+恰好完全轉化為Fe3+,測得此時溶液中Cl的濃度為0.460 mol·L1(溶液體積變化忽略不計)。
②另取水浸后溶液100.00 mL,向其中加入過量的1 mol·L1 NaOH溶液,充分反應后過濾、洗滌、灼燒,冷卻后,稱得固體粉末的質量為0.96 g。
試通過計算確定水浸后溶液中Fe2+、Fe3+的物質的量濃度(寫出計算過程)。
【答案】(1)
(2)3.7~9.9Fe(OH)3(3)取少量最后一次洗滌液,向其中加入硝酸酸化的AgNO3溶液,若無白色沉淀生成則證明已洗滌干凈(4)c(Fe2+)=0.005mol·L1c(Fe3+)=0.015mol·L1
【解析】
試題分析:(1)Fe(OH)2沉淀呈絮狀,不易從溶液中除去,因此氧化過程中Fe2+被氧化成Fe3+,離子方程式為: ;(2)調節pH是為了讓Fe3+變成沉淀除去,而Mg2+不沉淀,因此pH值的調節范圍是3.7—9.9,濾渣的主要成分是Fe(OH)3;(3)碳酸鎂晶須若未洗凈,則會含有NH4Cl溶液,因此證明碳酸鎂晶須已經洗滌干凈的方法取少量最后一次洗滌液,向其中加入硝酸酸化的AgNO3溶液,若無白色沉淀生成則證明已洗滌干凈;
;(2)調節pH是為了讓Fe3+變成沉淀除去,而Mg2+不沉淀,因此pH值的調節范圍是3.7—9.9,濾渣的主要成分是Fe(OH)3;(3)碳酸鎂晶須若未洗凈,則會含有NH4Cl溶液,因此證明碳酸鎂晶須已經洗滌干凈的方法取少量最后一次洗滌液,向其中加入硝酸酸化的AgNO3溶液,若無白色沉淀生成則證明已洗滌干凈;
(4)由關系式“2Fe2+~ Cl2~ 2Cl”可知,增加的Cl-的物質的量即為Fe2+的物質的量
n(Fe2+) =100×10-3×(0.460-0.455)=5.0×10-4mol
c(Fe2+)=5.0×10-4÷100×10-3=0.005mol·L1
固體的成分為Fe2O3、MgO
則[n(Fe3+)+n(Fe2+)]×0.5×160+n(Mg2+)×40=0.96
根據溶液中的電荷守恒:3n(Fe3+)+2n(Fe2+)+2n(Mg2+)=0.455×100×10-3
則n(Fe3+)=1.5×10-3mol
即c(Fe3+)=0.015mol·L1。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.鈉投入到水中 2Na+2H2O═2Na++2OH﹣+H2↑
B.氯化銨溶液與濃NaOH溶液加熱 NH4++OH﹣═NH3H2O
C.氯化鋁溶液中滴入過量氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
D.鐵片插入氯化鐵溶液中 Fe+Fe3+═2Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據所學知識完成題目:
(1)將CO2氣體持續通入澄清石灰水中,發現澄清石灰水先渾濁,后又變澄清,寫出在該過程中所涉及的化學方程式:
(2)Cu與濃硫酸反應的化學反應方程式: 其中在此反應中,硫酸體現了什么性質:
(3)海水提鎂中,貝殼的作用是(用化學反應方程式表示):
(4)工業上制備粗硅的化學方程式是:
(5)SiO2是玻璃的成分之一,SiO2與氫氧化鈉溶液反應的化學方程式為 , 工藝師常用(填物質名稱)來雕刻玻璃.
(6)工業上常采用碳酸鹽與石英為原料制取玻璃,請寫出工業制取玻璃的化學反應方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將兩種金屬單質組成的混合物11g,加到足量稀硫酸中,最終得到11.2L(標準狀況下)的氫氣,這兩種金屬可能是( )
A.Zn和Fe
B.Ag和Mg
C.Al和 Cu
D.Mg和Zn
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉常用作食品防腐劑。現用下圖所示儀器(夾持裝置已省略)及藥品。探究亞硝酸鈉與硫酸的反應及生成氣體產物的成分。巳知氣體液化的溫度:NO2:21℃;NO:-152 ℃
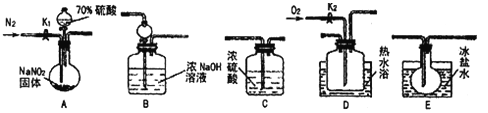
回答下列問題:
(1)為了檢驗裝置A中生成的氣體產物,儀器的連接順序為(按從左到右連接): A→C→___→____→______。
(2)組裝好儀器后,接下來進行的操作是____;實驗開始時通入N2的作用是______.
(3)關閉彈贊夾K1,打開分液漏斗活塞,滴入70%硫酸后,A中產生紅棕色氣體。確認A中產生的氣體中含有NO,依據的現象是__________;裝置E的作用是__________。
(4)根據上述實驗,寫出該反應的化學方程式:__________。
如果沒有裝置C,對驗證結論造成的影響是__________。
(5)實驗結束后還需通入N2的作用是_______;如果向D中通入過量O2,則裝置B中發生反應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將足量的SO3不斷通入KOH、Ba(OH)2、KAIO2三種物質的混合溶液中,如圖所示生成沉淀與加入SO3的物質的量的關系相符的圖象是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某無色溶液中緩慢地滴入NaOH溶液直至過量,產生沉淀的質量與加入的NaOH溶液體積的關系如圖所示,由此確定,原溶液中含有的陽離子是( ) 
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】主族元素在周期表中的位置取決于該元素原子的( )。
A. 相對原子質量和核外電子數
B. 電子層數和最外層電子數
C. 相對原子質量和最外層電子數
D. 電子層數和次外層電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物分子中,當某個碳原子連接著四個不同的原子或原子團時,這種碳原子稱為“手性碳原子”。例如,下圖有機物分子中帶“*”碳原子就是手性碳原子。該有機物分別發生下列反應,生成的有機物分子中仍含有手性碳原子的是:

A. 與乙酸發生酯化反應
B. 與NaOH水溶液反應
C. 與銀氨溶液作用只發生銀鏡反應
D. 催化劑作用下與H2反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com