
【題目】某種胃藥的止酸劑為碳酸鈣,測定每片中碳酸鈣含量的方法有以下幾步操作(設藥片中的其它成分不與鹽酸反應,也不與氫氧化鈉反應),實驗步驟如下:
①配制![]() 稀鹽酸和
稀鹽酸和![]() 溶液各
溶液各![]()
②取一粒藥片(![]() )研碎后加入
)研碎后加入![]() 蒸餾水
蒸餾水
③加入![]() 稀鹽酸
稀鹽酸
④用![]() 溶液中和過量鹽酸,用去體積為
溶液中和過量鹽酸,用去體積為![]() 。
。
請回答下列問題:
(1)測定過程中發生反應的離子方程式_________。
(2)配制上述![]() 稀鹽酸所用玻璃儀器有量筒、燒杯、________。
稀鹽酸所用玻璃儀器有量筒、燒杯、________。
(3)如果選用酚酞作指示劑,滴定達到終點的現象為____。
(4)某同學四次測定的![]() 數據如下:
數據如下:
測定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
請根據這位同學的實驗數據,計算藥片中碳酸鈣的質量分數為_____。
(5)若在實驗過程中存在下列操作,會使所測碳酸鈣的質量分數偏高的是_________。
a 用沒有潤洗的堿式滴定管裝![]() 溶液進行滴定
溶液進行滴定
b 用沒有潤洗的酸式滴定管量取![]() 稀鹽酸溶解樣品
稀鹽酸溶解樣品
c 用![]() 溶液滴定時,開始讀數平視,終點俯視
溶液滴定時,開始讀數平視,終點俯視
d 裝![]() 溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡。
溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O 玻璃棒、膠頭滴管、250mL容量瓶 當最后一滴NaOH溶液滴下,溶液由無色變為淡紅色,且半分鐘內不褪色 65.0% bc
【解析】
(1)測定過程中發生的反應有:藥片中的碳酸鈣與鹽酸的反應、鹽酸與氫氧化鈉溶液的反應,據此書寫反應的離子方程式;
(2)根據配制溶液的一般步驟分析解答;
(3)選用酚酞作指示劑,滴定終點時溶液變為粉紅色,據此解答;
(4)第一次數據誤差大,需要舍去,然后計算消耗NaOH的平均體積,結合反應的原理計算;
(5)中和反應過程中消耗NaOH的體積越小,碳酸鈣消耗的鹽酸就越多,碳酸鈣的質量分數就越高,據此分析判斷。
(1)測定過程中發生的反應有:藥片中的碳酸鈣與鹽酸的反應、鹽酸與氫氧化鈉溶液的反應,反應的離子方程式為CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O,故答案為:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O;
(2)配制250mL0.100mol/L稀鹽酸所用玻璃儀器有量筒、燒杯、玻璃棒、膠頭滴管、250mL容量瓶,故答案為:玻璃棒、膠頭滴管、250mL容量瓶;
(3)用NaOH溶液滴定鹽酸,選用酚酞作指示劑,酚酞在鹽酸中無色,因此滴定終點的現象為:溶液由無色變為淺紅色,半分鐘內不褪色,故答案為:當最后一滴NaOH溶液滴下,溶液由無色恰好變淡紅色,且半分鐘內不褪色;
(4)第一次數據誤差較大,應該省去,所以每片藥劑平均耗NaOH溶液體積為![]() =12.00mL,與CaCO3反應的鹽酸的體積為:25.00mL-12.00mL=13.00mL,則每片藥劑中CaCO3的質量分數為
=12.00mL,與CaCO3反應的鹽酸的體積為:25.00mL-12.00mL=13.00mL,則每片藥劑中CaCO3的質量分數為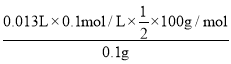 ×100%=65.0%,故答案為:65.0%;
×100%=65.0%,故答案為:65.0%;
(6)a.沒有潤洗就裝氫氧化鈉溶液進行滴定,則氫氧化鈉溶液被稀釋,滴定時造成V(堿)偏大,根據V(酸)=![]() 可知,V(酸)偏大,則與CaCO3反應的鹽酸的體積偏小,引起測量結果偏低,故a不選;b.沒有潤洗就裝HCl溶液進行滴定,則HCl被稀釋,鹽酸的濃度偏小,則與CaCO3反應的鹽酸的體積偏大,引起測量結果偏高,故b選;c.用氫氧化鈉溶液滴定時,開始平視,終點俯視,造成V(堿)偏小,根據V(酸)=
可知,V(酸)偏大,則與CaCO3反應的鹽酸的體積偏小,引起測量結果偏低,故a不選;b.沒有潤洗就裝HCl溶液進行滴定,則HCl被稀釋,鹽酸的濃度偏小,則與CaCO3反應的鹽酸的體積偏大,引起測量結果偏高,故b選;c.用氫氧化鈉溶液滴定時,開始平視,終點俯視,造成V(堿)偏小,根據V(酸)=![]() 可知,V(酸)偏小,則與CaCO3反應的鹽酸的體積偏大,引起測量結果偏高,故c選;d.裝NaOH溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡,造成V(堿)偏大,根據V(酸)=
可知,V(酸)偏小,則與CaCO3反應的鹽酸的體積偏大,引起測量結果偏高,故c選;d.裝NaOH溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡,造成V(堿)偏大,根據V(酸)=![]() 可知,V(酸)偏大,則與CaCO3反應的鹽酸的體積偏小,引起測量結果偏低,故d不選;故答案為:bc。
可知,V(酸)偏大,則與CaCO3反應的鹽酸的體積偏小,引起測量結果偏低,故d不選;故答案為:bc。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】分屬周期表前三周期的四種元素W、X、Y、Z可形成結構如圖的物質,該物質中所有原子均滿足穩定結構,W的原子序數最大,Y、Z處于同一周期。下列說法錯誤的是( )
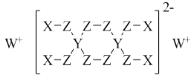
A.在該物質中,Y的化合價為+4價
B.X和Z可以形成具有強氧化性的化合物
C.由Z和W形成的化合物中可以存在共價鍵
D.X、Y、Z的原子半徑從大到小為Y>Z>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列表格,回答有關問題:

(1)上表中,第一電離能最小的元素是__(填元素名稱,下同),電負性最大的元素是__。
(2)某元素最高價氧化物對應的水化物呈兩性,寫出該元素與c元素形成的化合物與NaOH溶液反應的離子方程式__。
(3)在e~k元素的原子中,原子半徑最小的是___(填元素符號),其價電子排布式為__;未成對電子數最多的是__(填元素符號),其最高價氧化物對應水化物的化學式為__;有兩個未成對電子的元素是__(填元素符號);M層有兩個空軌道的是__(填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.ΔH<0、ΔS>0的反應在溫度低時不能自發進行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自發進行,原因是體系有自發地向混亂度增大的方向轉變的傾向
C.因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為反應自發性的判據
D.化學反應的限度不可以通過改變條件而改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.合成氨工業中,每生產![]() ,放出
,放出![]() 熱量。
熱量。
(1)寫出合成氨反應的熱化學方程式___________。
(2)已知:

![]() 鍵斷裂吸收的能量等于_______
鍵斷裂吸收的能量等于_______![]() (計算結果取整數)。
(計算結果取整數)。
Ⅱ.人工腎臟可用間接電化學方法除去代謝產物中的尿素[化學式為![]() ],原理如圖。
],原理如圖。
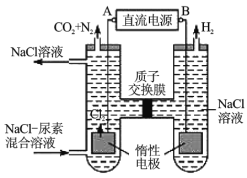
(1)電源的負極為__________(填“A”或“B”)。
(2)陽極室中發生的反應依次為_________,_________。
(3)電解結束后,陰極室溶液的![]() 與電解前相比將__________(填“增大”、“減小”或“不變”)。
與電解前相比將__________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上由乙苯生產苯乙烯的反應如下,下列有關說法正確的是 ( )
 +H2
+H2
A.該反應的類型為取代反應
B.苯乙烯分子中所有原子一定在同一平面上
C.乙苯和苯乙烯都能發生氧化反應
D.比乙苯多一個碳原子的同系物R的同分異構體(包含R,不含立體異構)共有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】富馬酸(反式丁烯二酸)與Fe2+形成的配合物——富馬酸亞鐵又稱富血鐵,可用于治療缺鐵性貧血。以下是合成富馬酸亞鐵的一種工藝路線:

回答下列問題:
(1)A的化學名稱為________;由A生成B的反應類型為______。
(2)C的結構簡式為______。
(3)富馬酸的結構簡式為______。
(4)檢驗富血鐵中是否含有Fe3+需要用的試劑是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用Na2SO3溶液吸收硫酸工業尾氣中的SO2,并通過電解方法實現吸收液的循環再生。其中陰、陽離子交換膜組合循環再生機理如圖所示,下列有關說法中正確的是

A.X應為直流電源的正極
B.電解過程中陰極區pH升高
C.圖中的b%<a%
D.SO32-在電極上發生的反應為SO32-+2OH--2e-=SO42-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解法利用 CO2制備甲酸鹽可實現 CO2資源化利用, 其裝置如圖所示:

下列說法錯誤的是
A.a 極為正極,K+由左向右通過交換膜
B.乙池中的反應為 CO2+HCO3-+2e-= HCOO-+ CO32-
C.電解過程中,Pt 電極產生的氣體可以用作燃料電池的負極反應
D.兩池的溶液 KHCO3濃度均降低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com