
【題目】取兩份鋁片,第一份與足量鹽酸反應,第二份與足量燒堿溶液反應,同溫同壓下放出相同體積的氣體,則兩份鋁片的質量之比為( )
A. 1:6 B. 2:3 C. 3:2 D. 1:1
科目:高中化學 來源: 題型:
【題目】實驗室使用pH傳感器來測定Na2CO3和NaHCO3混合物中NaHCO3的含量。稱取1.59 g樣品,溶于水配成250.00 mL溶液,取出該溶液25.00 mL用0.1 mol·L-1鹽酸進行滴定,得到如下曲線。以下說法或操作正確的是( )
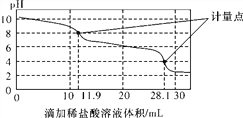
A. 上一個計量點前發生反應的離子方程式為HCO(+H+===H2O+CO2↑
B. 下一個計量點溶液中存在大量的陰離子是Cl-、HCO(
C. 此樣品n(NaHCO3)=(28.1-2×11.9)×10-4 mol
D. 使用該方法測定Na2CO3和NaOH混合溶液中的氫氧化鈉含量,將會得到1個計量點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)科學家尋找高效催化劑,通過如下反應實現大氣污染物轉化:
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
已知:CO的燃燒熱△H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)幾種化學鍵的鍵能數據如下:
化學鍵 | N≡N鍵 | O=O鍵 | NO中氮氫鍵 |
鍵能(kJ/mol) | 945 | 498 | 630 |
求△H1__________________。
(2)NH3作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃,在恒溫恒容裝置中充入一定量的NH3和O2,在某催化劑的作用下進行下述反應I,測得不同時間的NH3和O2的濃度如下表:
時間(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
則下列有關敘述中正確的是______________
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B. 若測得容器內4v正(NH3)=6v逆(H2O)時,說明反應已達平衡
C.當容器內![]() =1時,說明反應已達平衡
=1時,說明反應已達平衡
D.前10分鐘內的平均速率v(NO)=0.088mol·L-1·min-1
<>(3)氨催化氧化時會發生下述兩個競爭反應I、II。催化劑常具有較強的選擇性,即專一性。已知:反應I 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
反應 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1 mol NH3和2mol O2,測得有關物質的量關系如圖:

①該催化劑在高溫時選擇反應____________ (填“ I ”或“ II”)。
② 520℃時,4NH3(g)+3O2![]() 4N2(g) +6H2O(g)的平衡常數K=________________ (不要求得出計算結果,只需列出數字計算式)。
4N2(g) +6H2O(g)的平衡常數K=________________ (不要求得出計算結果,只需列出數字計算式)。
③由圖像可判斷,反應I正反應△H_______________ 0(填“>”、“<”,或“=”)
④C點比B點所產生的NO的物質的量少的主要原因_________________________。
(4)羥胺(NH2OH)的電子式_____________,羥胺是一種還原劑,可用作顯像劑還原溴化銀生成銀單質和氮氣,該反應的化學方程式為______________________________。
現用25.00mL0.049mol/L的羥胺的酸性溶液跟足量的硫酸鐵溶液在煮沸條件下反應,生成的Fe2+恰好與24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,則在上述反應中,羥胺的氧化產物是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學—選修5:有機化學基礎]
G是抗炎癥藥物的中間體,其合成過程如下:

已知:Ⅰ. Ⅱ.
Ⅱ. (具有較強的還原性)
(具有較強的還原性)
(1)B的結構簡式為_________;
(2)反應④的條件為_________;反應①的反應類型為_______;反應②的作用是_________ ;
(3)下列關于G中的描述正確的是___________;
A.具有兩性,既能與酸反應也能與堿反應
B.能發生加成、消去、取代和氧化反應
C.能聚合成高分子化合物
D.1molG與足量NaHCO3溶液反應放出2molCO2
(4)D與足量的NaOH溶液反應的化學方程式為_______________________________
(5)符合下列條件的C的同分異構體有_________種
a.屬于芳香族化合物,且含有兩個甲基 b.能發生銀鏡反應
c.與FeCl3溶液發生顯色反應
其中核磁共振氫譜有4組峰,且峰面積之比為6:2:1:1的是_____________________。
(6)已知:苯環上有烷烴基時,新引入的取代基連在苯環的鄰對位;苯環上有羧基時,新引入的取代基連在苯環的間位。依據題意,寫出以甲苯為原料合成鄰氨基苯甲酸的流程圖(無機試劑任選):_____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.有四種化合物W、X、Y、Z,它們是由短周期元素A、B、C、D、E中的兩種元素組成。已知
(1)A、B、C、D、E的原子序數依次增大,且A、D同主族,C、E同主族;B、C 同周期;
(2)W由A、B組成,其分子中原子個數比為A:B=4:1,常溫為氣態。
(3)X由A、C組成,其分子中原子數比為A:C=1:1
(4)Y是C、D形成的離子化合物,且Y晶體中相應元素的原子個數比為1:1
(5)Z是由D、E形成的離子化合物,其中陽離子比陰離子少一個電子層,陽離子數與陰離子數之比為2:1 則B為__________,W為_________,X的結構式________Y的電子式為______________。
II.(1).一元素原子的N層上只有1個電子,該元素原子各內層均已充滿,寫出該原子電子排布式:________________,
(2)一元素屬于短周期元素,該元素的原子核外所有P軌道全滿或者半滿,寫出該元素原子的價電子軌道排布圖__________________,
(3)乙烯分子中有__________個σ鍵,___________π鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[2016·天津]氫能是發展中的新能源,它的利用包括氫的制備、儲存和應用三個環節。回答下列問題:
(1)與汽油相比,氫氣作為燃料的優點是 (至少答出兩點)。但是氫氣直接燃燒的能量轉換率遠低于燃料電池,寫出堿性氫氧燃料電池的負極反應式: 。
(2)氫氣可用于制備H2O2。已知:
H2(g)+A(l) ![]() B(l) ΔH1
B(l) ΔH1
O2(g)+B(l) ![]() A(l)+H2O2(l) ΔH2
A(l)+H2O2(l) ΔH2
其中A、B為有機物,兩反應均為自發反應,則H2(g)+O2(g) ![]() H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
(3)在恒溫恒容的密閉容器中,某儲氫反應:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0達到化學平衡。下列有關敘述正確的是 。
MHx+2y(s) ΔH<0達到化學平衡。下列有關敘述正確的是 。
a.容器內氣體壓強保持不變
b.吸收y mol H2只需1 mol MHx
c.若降溫,該反應的平衡常數增大
d.若向容器內通入少量氫氣,則v(放氫)>v(吸氫)
(4)利用太陽能直接分解水制氫,是最具吸引力的制氫途徑,其能量轉化形式為 。
(5)化工生產的副產氫也是氫氣的來源。電解法制取有廣泛用途的Na2FeO4。同時獲得氫氣:Fe+2H2O+2OH![]()
![]() +3H2↑,工作原理如圖1所示。裝置通電后,鐵電極附近生成紫紅色
+3H2↑,工作原理如圖1所示。裝置通電后,鐵電極附近生成紫紅色![]() ,鎳電極有氣泡產生。若氫氧化鈉溶液濃度過高,鐵電極區會產生紅褐色物質。已知:Na2FeO4只在強堿性條件下穩定,易被H2還原。
,鎳電極有氣泡產生。若氫氧化鈉溶液濃度過高,鐵電極區會產生紅褐色物質。已知:Na2FeO4只在強堿性條件下穩定,易被H2還原。

①電解一段時間后,c(OH)降低的區域在 (填“陰極室”或“陽極室”)。
②電解過程中,須將陰極產生的氣體及時排出,其原因為 。
③c(Na2FeO4)隨初始c(NaOH)的變化如圖2,任選M、N兩點中的一點,分析c(Na2FeO4)低于最高值的原因: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源是人類生存和發展的重要支柱,化學在能源的開發與利用方面起著十分重要的作用。某學習小組按如下圖所示裝置探究化學能與電能的相互轉化:
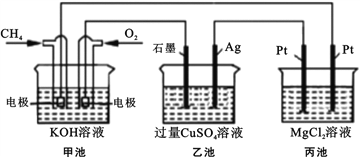
(1) 甲池是_____裝置,通入CH4氣體的電極上的反應式為_____。乙池中SO42- 移向_____電極(填“石墨”或“Ag”)
(2) 當甲池消耗標況下33.6LO2時,電解質KOH的物質的量變化_____mol,乙池若要恢復電解前的狀態則需要加入_____g _____(填物質名稱)。
(3) 丙池中發生的電解反應的離子方程式為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com