
【題目】關(guān)于![]() 溶液,下列判斷不正確的是 ( )
溶液,下列判斷不正確的是 ( )
A. 粒子種類與![]() 溶液相同
溶液相同
B. 升高溫度,![]() 增大
增大
C. 加入![]() 溶液,
溶液,![]() 減小
減小
D. ![]()
【答案】B
【解析】
從溶質(zhì)的溶解直至水的電離,可知溶液中粒子種類;根據(jù)外因?qū)瘜W(xué)平衡的影響分析濃度變化;由溶液的電中性原理可寫電荷守恒關(guān)系。
A項(xiàng):溶液中Na2CO3完全電離Na2CO3=2Na++CO32-,CO32-分兩步水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH- ,水的電離H2O
H2CO3+OH- ,水的電離H2O![]() H++OH- 。同理可寫出
H++OH- 。同理可寫出![]() 溶液的各種過(guò)程,兩溶液中粒子種類相同,A項(xiàng)正確;
溶液的各種過(guò)程,兩溶液中粒子種類相同,A項(xiàng)正確;
B項(xiàng):CO32-水解過(guò)程吸熱,升高溫度使水解平衡右移,![]() 減小,B項(xiàng)錯(cuò)誤;
減小,B項(xiàng)錯(cuò)誤;
C項(xiàng):加入![]() 溶液,Ca2+與CO32-結(jié)合生成難溶于水的CaCO3沉淀,使
溶液,Ca2+與CO32-結(jié)合生成難溶于水的CaCO3沉淀,使![]() 減小,C項(xiàng)正確;
減小,C項(xiàng)正確;
D項(xiàng):水溶液都是電中性的,符合電荷守恒![]() ,D項(xiàng)正確。
,D項(xiàng)正確。
本題選B。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】工業(yè)上使用Au 基體催化CO2 合成甲酸的反應(yīng)過(guò)程如圖所示。下列說(shuō)法不正確的是
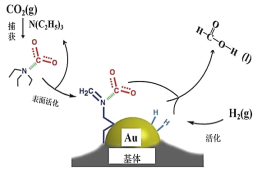
A.二氧化碳的電子式為![]()
B.在捕獲過(guò)程,二氧化碳分子中的共價(jià)鍵完全斷裂
C.N(C2H5)3 能夠協(xié)助二氧化碳到達(dá)催化劑表面
D.CO2 催化加氫合成甲酸的總反應(yīng)式為H2(g)+CO2(g)=HCOOH(l)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】利用電解質(zhì)溶液的濃度對(duì)電極電勢(shì)的影響,可設(shè)計(jì)濃差電池。某熱再生濃差電池工作原理如圖所示,通入NH3時(shí)電池開(kāi)始工作,左側(cè)電極質(zhì)量減少,右側(cè)電極質(zhì)量增加,中間A為陰離子交換膜,放電后可利用廢熱進(jìn)行充電再生。已知:Cu2++4NH3![]()
![]() ,下列說(shuō)法不正確的是
,下列說(shuō)法不正確的是
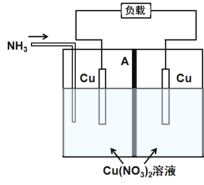
A.放電時(shí),左側(cè)電極發(fā)生氧化反應(yīng):Cu+4NH3-2e=![]()
B.放電時(shí),電池的總反應(yīng)為Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放電時(shí),![]() 經(jīng)離子交換膜由右側(cè)向左側(cè)遷移
經(jīng)離子交換膜由右側(cè)向左側(cè)遷移
D.上述原電池的形成說(shuō)明,相同條件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】氯堿工業(yè)的原理示意圖如圖。下列說(shuō)法正確的是
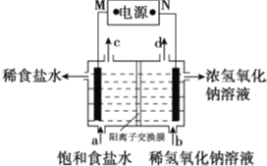
A. M為負(fù)極
B. 通電使氯化鈉發(fā)生電離
C. 出口c收集到的物質(zhì)是氯氣
D. 通電一段時(shí)間后,陰極區(qū)pH降低
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】鉻是一種重要的金屬元素,具有多種價(jià)態(tài),單質(zhì)鉻是硬度最大的金屬,熔點(diǎn)為![]() 。回答下列問(wèn)題:
。回答下列問(wèn)題:
![]() 工業(yè)上以鉻鐵礦
工業(yè)上以鉻鐵礦![]() 主要成分是
主要成分是![]() 為原料冶煉鉻的流程如圖所示:
為原料冶煉鉻的流程如圖所示:
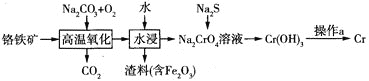
![]() 中鉻元素的化合價(jià)為_________。
中鉻元素的化合價(jià)為_________。
![]() 高溫氧化時(shí)發(fā)生反應(yīng)的化學(xué)方程式為________________。
高溫氧化時(shí)發(fā)生反應(yīng)的化學(xué)方程式為________________。
![]() 操作a由兩種均發(fā)生了化學(xué)反應(yīng)的過(guò)程構(gòu)成,其分別是_________、鋁熱反應(yīng)。
操作a由兩種均發(fā)生了化學(xué)反應(yīng)的過(guò)程構(gòu)成,其分別是_________、鋁熱反應(yīng)。
![]() 是兩性氫氧化物,請(qǐng)寫出其電離方程式_________________。
是兩性氫氧化物,請(qǐng)寫出其電離方程式_________________。
![]() 鉻元素能形成含氧酸及含氧酸鹽,若測(cè)得濃度為
鉻元素能形成含氧酸及含氧酸鹽,若測(cè)得濃度為![]() 的鉻酸
的鉻酸![]() 溶液中含鉻元素的微粒濃度分別為
溶液中含鉻元素的微粒濃度分別為![]() 、
、![]() 、
、![]() ,試推測(cè)
,試推測(cè)![]() 溶液呈________
溶液呈________![]() 填“酸”“堿”或“中”
填“酸”“堿”或“中”![]() 性,原因是______________。
性,原因是______________。
![]() 水中的鉻元素對(duì)水質(zhì)及環(huán)境均有嚴(yán)重的損害作用,工業(yè)上用下述方法來(lái)進(jìn)行無(wú)害化處理并獲得有價(jià)值的產(chǎn)品。
水中的鉻元素對(duì)水質(zhì)及環(huán)境均有嚴(yán)重的損害作用,工業(yè)上用下述方法來(lái)進(jìn)行無(wú)害化處理并獲得有價(jià)值的產(chǎn)品。
![]() 電解處理含有
電解處理含有![]() 的污水:用鐵作電極電解污水,
的污水:用鐵作電極電解污水,![]() 被陽(yáng)極區(qū)生成的離子還原成
被陽(yáng)極區(qū)生成的離子還原成![]() ,生成的
,生成的![]() 與陰極區(qū)生成的
與陰極區(qū)生成的![]() 結(jié)合生成
結(jié)合生成![]() 沉淀而除去。則陰極上的電極反應(yīng)式為_______,若要處理
沉淀而除去。則陰極上的電極反應(yīng)式為_______,若要處理![]() 濃度為
濃度為![]() 的污水,理論上需要消耗_______kg的鐵。
的污水,理論上需要消耗_______kg的鐵。
![]() 轉(zhuǎn)化為有價(jià)值的產(chǎn)品磁性鐵鉻氧體
轉(zhuǎn)化為有價(jià)值的產(chǎn)品磁性鐵鉻氧體![]() :先向含
:先向含![]() 的污水中加入適量的硫酸及硫酸亞鐵,待充分反應(yīng)后再通入適量空氣
的污水中加入適量的硫酸及硫酸亞鐵,待充分反應(yīng)后再通入適量空氣![]() 氧化部分
氧化部分![]() 并加入NaOH,就可以使鉻、鐵元素全部轉(zhuǎn)化為磁性鐵鉻氧體。寫出
并加入NaOH,就可以使鉻、鐵元素全部轉(zhuǎn)化為磁性鐵鉻氧體。寫出![]() 在酸性條件下被
在酸性條件下被![]() 還原為
還原為![]() 的離子方程式__________,若處理含
的離子方程式__________,若處理含![]() 不考慮其他含鉻微粒
不考慮其他含鉻微粒![]() 的污水時(shí)恰好消耗
的污水時(shí)恰好消耗![]() ,則當(dāng)鐵鉻氧體中
,則當(dāng)鐵鉻氧體中![]() 時(shí),鐵鉻氧體的化學(xué)式為_______________。
時(shí),鐵鉻氧體的化學(xué)式為_______________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】二氧化錳是制造鋅錳干電池的基本材料。工業(yè)上以軟錳礦為原料,利用硫酸亞鐵制備高純度二氧化錳的流程如圖1:
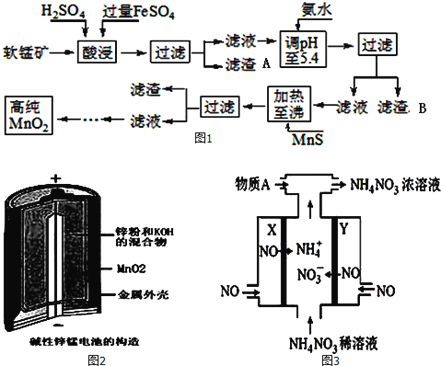
某軟錳礦的主要成分為MnO2,還含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分陽(yáng)離子以氫氧化物或硫化物的形式完全沉淀時(shí)溶液的pH如表,回答下列問(wèn)題
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亞鐵在酸性條件下將MnO2還原為MnSO4,酸浸時(shí)發(fā)生的主要反應(yīng)的化學(xué)方程式為__________;
(2)濾渣A的主要成分是____________;濾渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+雜質(zhì),可能原因是_________________;
(4)堿性鋅錳電池是一種一次性電池,其結(jié)構(gòu)如圖2所示.該電池放電過(guò)程產(chǎn)生MnOOH.該電池的正極反應(yīng)式為________________,電池總反應(yīng)的方程式為_______________________;
(5)利用該堿性鋅錳電池電解NO制備NH4NO3,其工作原理如圖3所示,X電極__________極,電解時(shí)陽(yáng)極的電極反應(yīng)為________________,使電解產(chǎn)物全部轉(zhuǎn)化為NH4NO3,需補(bǔ)充物質(zhì)A,A是__________;
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】芯片主要由單晶體硅成。下圖是硅及其化合物的類價(jià)二維圖,根據(jù)要求完成下列化學(xué)方程式或離子方程式。

(1)利用焦炭在電爐中還原二氧化硅的化學(xué)方程式為_______________。
(2)利用氫氟酸刻蝕玻璃的化學(xué)方程式為_______________。
(3)硅酸鈉轉(zhuǎn)化為原硅酸的離子方程式_______________。
(4)二氧化硅與燒堿溶液反應(yīng)的化學(xué)方程式_______________。
(5)石英與純堿在玻璃熔爐里加強(qiáng)熱發(fā)生反應(yīng)的化學(xué)方程式為_______________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】在120 ℃時(shí),以任意質(zhì)量比混合的某烴的混合物和過(guò)量 O2 在一密閉容器中完全反應(yīng),測(cè)知反應(yīng)前后的壓強(qiáng)沒(méi)有變化,則該混合烴可能是( )
A.CH4和C2H4B.CH4和C2H6C.C2H4和C2H6D.C2H2和C3H6
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】實(shí)驗(yàn)室用![]() 與
與![]() 制取
制取![]() 氣體,再由
氣體,再由![]() 在強(qiáng)堿性條件下與過(guò)量的
在強(qiáng)堿性條件下與過(guò)量的![]() 反應(yīng)制得漂白劑
反應(yīng)制得漂白劑![]() 裝置如圖1所示
裝置如圖1所示![]() .
.
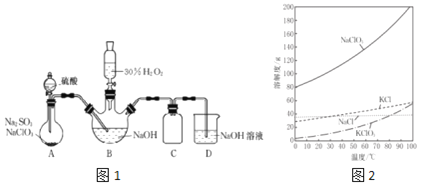
已知![]() 如圖
如圖![]() :
:![]() 飽和溶液在溫度低于
飽和溶液在溫度低于![]() 時(shí)析出的晶體是
時(shí)析出的晶體是![]() ,高于
,高于![]() 時(shí)析出晶體是
時(shí)析出晶體是![]() ;
;![]() Ⅱ
Ⅱ![]()
![]() 超過(guò)
超過(guò)![]() 時(shí)會(huì)完全分解;
時(shí)會(huì)完全分解;![]() Ⅲ
Ⅲ![]() 高于
高于![]() 時(shí)
時(shí)![]() 分解成
分解成![]() 和NaCl.
和NaCl.
![]() 圖1裝置A發(fā)生的反應(yīng)中,還原劑是______.
圖1裝置A發(fā)生的反應(yīng)中,還原劑是______.
![]() 圖1裝置B中反應(yīng)生成
圖1裝置B中反應(yīng)生成![]() 的化學(xué)方程式為______.
的化學(xué)方程式為______.
![]() 實(shí)驗(yàn)中圖1裝置B需進(jìn)行溫度控制不超過(guò)
實(shí)驗(yàn)中圖1裝置B需進(jìn)行溫度控制不超過(guò)![]() ,在不改變NaOH溶液濃度和體積的條件下,可采取的措施有______、______.
,在不改變NaOH溶液濃度和體積的條件下,可采取的措施有______、______.
![]() 請(qǐng)補(bǔ)充從圖1裝置B反應(yīng)后的溶液中獲得
請(qǐng)補(bǔ)充從圖1裝置B反應(yīng)后的溶液中獲得![]() 晶體的操作步驟.
晶體的操作步驟.
![]() 在
在![]() 時(shí)蒸發(fā)結(jié)晶;
時(shí)蒸發(fā)結(jié)晶;![]() ______;
______;![]() ______;
______;![]() ______;得到成品.
______;得到成品.
![]() 圖1裝置C的作用是______.
圖1裝置C的作用是______.
![]() 證明實(shí)驗(yàn)后圖1裝置B所得混合溶液中的
證明實(shí)驗(yàn)后圖1裝置B所得混合溶液中的![]() 具有氧化性的實(shí)驗(yàn)方案是______
具有氧化性的實(shí)驗(yàn)方案是______![]() 可供選用的試劑:稀
可供選用的試劑:稀![]() 、
、![]() 溶液、KSCN溶液
溶液、KSCN溶液![]()
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com