
【題目】已知反應
①![]()
②稀溶液中,![]() ,
,
下列結論正確的是![]()
A.碳的燃燒熱為![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 濃
濃![]() 與1molNaOH溶液混合,產(chǎn)生
與1molNaOH溶液混合,產(chǎn)生![]() 熱量
熱量
D.稀醋酸與稀NaOH溶液反應生成1mol水,放出![]() 熱量
熱量
科目:高中化學 來源: 題型:
【題目】乙烯是合成食品外包裝材料聚乙烯的單體,可以由丁烷裂解制備。
主反應:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反應:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列問題:
CH4(g)+C3H6(g) ΔH2 回答下列問題:
(1)化學上,將穩(wěn)定單質的能量定為0,生成穩(wěn)定化合物時的釋放或吸收能量叫生成熱,生成熱可表示該物質相對能量。下表為25℃、101 kPa下幾種有機物的生成熱:
物質 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 異丁烷 |
生成熱/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物質,最穩(wěn)定的是________________(填結構簡式)。
②上述反應中,ΔH1=____________kJ·mol1。
(2)一定溫度下,在恒容密閉容器中投入一定量正丁烷發(fā)生反應生成乙烯。下列情況表明該反應達到平衡狀態(tài)的是_________________(填代號)。
A.氣體密度保持不變 B.![]() 保持不變
保持不變
C.反應熱不變 D.正丁烷分解速率和乙烷消耗速率相等
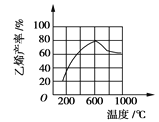
(3)向密閉容器中充入丁烷,在一定條件(濃度、催化劑及壓強等)下發(fā)生反應,測得乙烯產(chǎn)率與溫度關系如圖所示。溫度高于600℃時,
隨著溫度升高,乙烯產(chǎn)率降低,可能的原因是____________(填代號)。
A.平衡常數(shù)降低 B.活化能降低
C.催化劑活性降低 D.副產(chǎn)物增多
(4)在一定溫度下向1 L恒容密閉容器中充入2 mol正丁烷,反應生成乙烯和乙烷,經(jīng)過10 min 達到平衡狀態(tài),測得平衡時氣體壓強是原來的1.75倍。
①0~10 min內乙烷的生成速率v(C2H6)為___________mol·L1·min1。
②上述條件下,正丁烷的平衡轉化率為_____________;該反應的平衡常數(shù)K為____。
(5)丁烷空氣燃料電池以熔融的K2CO3(其中不含O2和HCO3-)為電解質,以具有催化作用和導電性能的稀土金屬材料為電極。該燃料電池的正極反應式為26CO2+13O2+52e=6CO32-,負極反應式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與能源開發(fā)、環(huán)境保護、資源利用等密切相關。下列說法不正確的是( )
A.煤的氣化、液化、干餾和石油的裂化、裂解、催化重整都是化學變化
B.向污水中投放明礬,利用生成的膠體凈水:![]()
![]() 膠體
膠體![]()
C.氫能是清潔能源,工業(yè)上電解水法制大量氫氣符合節(jié)能減排理念
D.“光化學煙霧”、“硝酸型酸雨”的形成都與氮氧化合物有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烷烴和某單烯烴的混合氣體2.24 L(標準狀況),使其完全燃燒,產(chǎn)生的氣體完全通過濃硫酸,濃硫酸質量增加4.50 g,剩余氣體通過堿石灰,堿石灰質量增加了7.70 g,另取該混合氣體2.24 L(標準狀況),通過足量溴水,溴水質量增加了1.40 g。該混合氣體由哪兩種烴組成( )
A.甲烷和丙烯B.甲烷和丁烯C.乙烷和乙烯D.乙烷和丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】華為集團在通信網(wǎng)絡、IT、智能終端和云服務等領域為客戶提供有競爭力、安全可信賴的產(chǎn)品、解決方案與服務,與生態(tài)伙伴開放合作,持續(xù)為客戶創(chuàng)造價值,釋放個人潛能,豐富家庭生活,激發(fā)組織創(chuàng)新。華為堅持圍繞客戶需求持續(xù)創(chuàng)新,加大基礎研究投入,厚積薄發(fā),推動世界進步。其中MATE30手機采用鋰離子電池,其正極材料為磷酸亞鐵鋰(LiFePO4),它具有熱穩(wěn)定性好、循環(huán)性能優(yōu)良、安全性高等特點,文獻報道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作為原料制備。回答下列問題:
(1)在周期表中,與Li的化學性質最相似的鄰族元素是________,該元素基態(tài)原子核外M層電子的自旋狀態(tài)_______(填“相同”或“相反”)。
(2)FeCl3中的化學鍵具有明顯的共價性(類似于氯化鋁),蒸汽狀態(tài)下以雙聚分子存在的FeCl3的結構式為____,其中Fe的配位數(shù)為____。
(3)苯胺(![]() )的晶體類型是_____。苯胺與甲苯(
)的晶體類型是_____。苯胺與甲苯(![]() )的相對分子質量相近,但苯胺的熔點(-5.9℃)、沸點(184.4℃)分別高于甲苯的熔點(-95.0℃)、沸點(110.6℃),原因是_______。
)的相對分子質量相近,但苯胺的熔點(-5.9℃)、沸點(184.4℃)分別高于甲苯的熔點(-95.0℃)、沸點(110.6℃),原因是_______。
(4)NH4H2PO4中,電負性最高的元素是______;其中PO43-采用_______雜化。
(5)如下圖所示為高溫超導領域里的一種化合物——鈣鈦礦的晶體結構,該結構是具有代表性的最小重復單位。該物質的化學式可表示為_____;若鈣、鈦、氧三元素的相對原子質量分別為a、b、c,晶體結構圖中正方體邊長(鈦原子之間的距離)為d nm(1 nm=10-10Cm),則該晶體的密度為__g·cm-3。
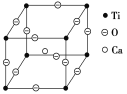
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在![]() 時,在濃度為
時,在濃度為![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的電離常數(shù)約等于一水合氨的電離常數(shù),下列判斷正確的是
的溶液中,已知醋酸的電離常數(shù)約等于一水合氨的電離常數(shù),下列判斷正確的是![]()
A.由水電離出的![]() 最大的是
最大的是![]()
B.三種溶液的pH值最小的![]()
C.三種溶液中![]() 最大的是
最大的是![]()
D.三種溶液中只有![]() 顯堿性
顯堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知AgI為黃色沉淀,AgCl為白色沉淀,![]() 時,AgI飽和溶液中
時,AgI飽和溶液中![]() 為
為![]() ,AgCl飽和溶液中
,AgCl飽和溶液中![]() 為
為![]() 。若在5mL含有KCl和KI濃度均為
。若在5mL含有KCl和KI濃度均為![]() 的混合溶液中,滴加8mL
的混合溶液中,滴加8mL![]() 的
的![]() 溶液,則下列敘述中不正確的是
溶液,則下列敘述中不正確的是
A.溶液中所含溶質的離子濃度大小關系為:![]()
B.溶液中先產(chǎn)生的是AgI沉淀
C.AgCl的![]() 的數(shù)值為
的數(shù)值為![]()
D.在AgI懸濁液中滴加KCl溶液,可能使黃色沉淀轉變成白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在高中階段化學學科中所涉及的平衡理論主要包括:化學平衡、電離平衡、水解平衡和難溶電解質溶解平衡四種,均符合勒夏特列原理,它們在工農(nóng)業(yè)生產(chǎn)中都有廣泛的應用。請回答下列問題:

Ⅰ:(1)工業(yè)生產(chǎn)尿素的原理是以![]() 和
和![]() 為原料合成尿素
為原料合成尿素![]() ,反應的化學方程式為:
,反應的化學方程式為:![]() 。
。
①已知該反應的平衡常數(shù)![]() ,則該反應的
,則該反應的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定溫度和壓強下,若原料氣中的![]() 和
和![]() 的物質的量之比
的物質的量之比![]() 氨碳比
氨碳比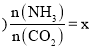 ,圖1是氨碳比
,圖1是氨碳比![]() 與
與![]() 平衡轉化率
平衡轉化率![]() 的關系,
的關系,![]() 隨著x增大的原因是______;B點處,
隨著x增大的原因是______;B點處,![]() 的體積分數(shù)為______
的體積分數(shù)為______![]() 保留小數(shù)點后一位
保留小數(shù)點后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一個帶活塞的密閉真空容器中在一定溫度下反應達平衡,若在恒溫、恒容下充入氣體He,
放在一個帶活塞的密閉真空容器中在一定溫度下反應達平衡,若在恒溫、恒容下充入氣體He,![]() 的質量______
的質量______![]() 填“增加”、“減小”或“不變”
填“增加”、“減小”或“不變”![]() 。
。
Ⅱ:(1)某溫度下,純水中![]() ,該溫度下,
,該溫度下,![]() NaOH溶液與
NaOH溶液與![]() HCl溶液等體積混合
HCl溶液等體積混合![]() 不考慮溶液體積變化
不考慮溶液體積變化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固體,溶液pH增大,主要原因是
固體,溶液pH增大,主要原因是![]() 請用學過的平衡理論解釋
請用學過的平衡理論解釋![]() ______;已知該混合溶液中
______;已知該混合溶液中![]() ,則
,則![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)圖2為某溫度下,![]() 、
、![]() 、
、![]() 分別在溶液中達到沉淀溶解平衡后,溶液的
分別在溶液中達到沉淀溶解平衡后,溶液的![]() 濃度、金屬陽離子濃度變化情況。如果向三種沉淀中加鹽酸,最先溶解的是______
濃度、金屬陽離子濃度變化情況。如果向三種沉淀中加鹽酸,最先溶解的是______![]() 填化學式
填化學式![]() 。
。
(2)向新生成的ZnS濁液中滴入足量含相同濃度的![]() 、
、![]() 的溶液,振蕩后,ZnS沉淀最終會轉化為______
的溶液,振蕩后,ZnS沉淀最終會轉化為______![]() 填化學式
填化學式![]() 沉淀。
沉淀。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某燒堿溶液中含有少量雜質(不與鹽酸反應),現(xiàn)用中和滴定測定其濃度。
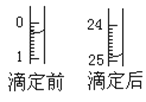
(1)用___式滴定管盛裝cmol/L鹽酸標準液。配制c mol/L鹽酸標準液,必須使用的主要容器是___。如圖表示某次滴定時50mL滴定管中前后液面的位置。滴定管讀數(shù)時應注意___。用去的標準鹽酸的體積是___mL。
(2)該實驗應選用__(填“酚酞”或者“石蕊”)作指示劑;操作中如何確定終點?__。
(3)對下列兩種假定情況進行討論:(填“無影響”、“偏高”、“偏低”)
a.若滴定前用蒸餾水沖洗錐形瓶,則會使測定結果___;
b.若在滴定過程中不慎將數(shù)滴酸液滴在錐形瓶外,則會使測定結果___;
C,讀數(shù)時,若滴定前仰視,滴定后俯視,則會使最終測定結果___。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com