
(1)元素M是短周期元素,其常量存在于海水中,單質被譽為“國防金屬”。
①M的原子結構示意圖為______。
②以M、Al為電極,KOH溶液為電解質溶液,則負極的電極反應式為______。
(2)淬火是將金屬工件加熱到某溫度,隨即浸入淬冷介質中快速冷卻的金屬熱處理工藝。
①使用水進行淬火,若生成磁性氧化鐵,該反應的化學方程式為____________
②驗證鐵用水淬火后的固體產物是否存在+3價的鐵,可選用的試劑為_______ (填序號)
| A.H2O2溶液 | B.銅粉 | C.稀硫酸 | D.KMnO4溶液 |
 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2
(15分)(1)①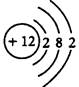 (2分)
(2分)
②Al+4OH——3e—=[Al(OH)4]—或AlO2—+2H2O(2分)
(2)①3Fe+4H2O Fe3O4+4H2↑(3分)
Fe3O4+4H2↑(3分)
②BC(2分)
(3)①6.9×10—7mol?L—1?mol—1(2分)
②不變(2分)
③>(2分)
解析試題分析:(1)①根據題意可知M為鎂,核電荷數為+12,核外電子層結構為282;②鎂不溶于KOH溶液,鋁能溶于KOH溶液,則鋁作負極,發生氧化反應,反應式為Al+4OH——3e—=[Al(OH)4]—或AlO2—+2H2O;(2)①紅熱的鐵與冷水反應,生成四氧化三鐵和氫氣,即3Fe+4H2O Fe3O4+4H2↑;②Fe3O4是堿性氧化物,能溶于稀硫酸,生成水、Fe3+和Fe2+,雙氧水和高錳酸鉀均能氧化Fe2+,銅粉能還原Fe3+,Fe3+能氧化銅,故BC正確;(3)①讀圖可知,△c(FeO42—)=(1.0—0.45)×10—3mol/L,由△c/△t可知,v(FeO42—)=(1.0—0.45)×10—3mol/L÷800min=6.867×10—7mol/(L?min)≈6.9×10—7mol/(L?min);②隨著pH變大,但溫度不變,故平衡常數不變;③隨著溫度升高,c(FeO42—)減小,則平衡右移,說明正反應是吸熱反應,其△H>0。
Fe3O4+4H2↑;②Fe3O4是堿性氧化物,能溶于稀硫酸,生成水、Fe3+和Fe2+,雙氧水和高錳酸鉀均能氧化Fe2+,銅粉能還原Fe3+,Fe3+能氧化銅,故BC正確;(3)①讀圖可知,△c(FeO42—)=(1.0—0.45)×10—3mol/L,由△c/△t可知,v(FeO42—)=(1.0—0.45)×10—3mol/L÷800min=6.867×10—7mol/(L?min)≈6.9×10—7mol/(L?min);②隨著pH變大,但溫度不變,故平衡常數不變;③隨著溫度升高,c(FeO42—)減小,則平衡右移,說明正反應是吸熱反應,其△H>0。
考點:考查鎂的存在、原子結構示意圖、新型電池的負極反應式、鋁的主要性質、鐵及其化合物的性質、化學反應速率、化學平衡常數、反應熱、溫度對化學平衡的影響等相關知識。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:填空題
把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后,產生1.16g白色沉淀,再向所得濁液中逐漸加入1.00mol/LHCl溶液,加入HCl溶液的體積與生成沉淀的關系如圖所示。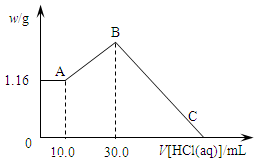
(1)A點的沉淀物的化學式為 。
(2)寫出A點至B點發生反應的離子方程式: 。
(3)原混合物中NaOH的質量是 g,C點(此時沉淀恰好完全溶解)HCl溶液的體積為 mL。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有一種細菌在酸性水溶液、氧氣存在下,可以將黃銅礦(主要成分是CuFeS2,含少量雜質SiO2)氧化成硫酸鹽。運用該原理生產銅和綠礬(FeSO4·7H2O)的流程如下: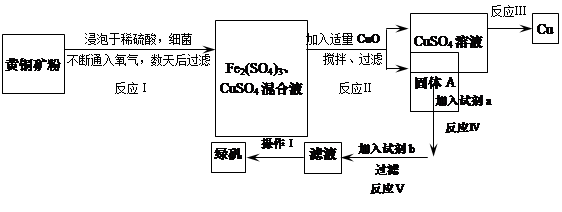
回答下列問題:
(1)已知:
| | Fe2+ | Cu2+ | Fe3+ |
| 開始轉化成氫氧化物沉淀時的pH | 7.6 | 4.7 | 2.7 |
| 完全轉化成氫氧化物沉淀時的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上,將黃銅礦(CuFeS2)通過8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反應制取銅及其硫和鐵的化合物。
8Cu+4FeO+2Fe2O3+16SO2反應制取銅及其硫和鐵的化合物。
(1)上述反應中,還原劑為 。
(2)黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為:
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒得Fe2O3。
據以上信息回答下列問題:
a.通過上述②,爐渣中的Al2O3變成了 (寫離子)。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所選試劑為 。
證明爐渣中含有FeO的實驗現象為 。
(3)對上述爐渣中進行含鐵量的測定步驟如下: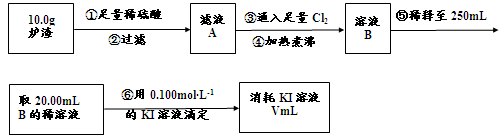
I.步驟③發生反應的離子方程式為 。
II.步驟④中煮沸的作用是 。
III.步驟⑤中用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管、 。
IV.若滴定過程中消耗0.100mol·L?1KI溶液20.00mL,則爐渣中鐵的百分含量為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鋁土礦(主要成分為Al2O3,還有少量雜質)是提取氧化鋁的原料。提取氧化鋁的工藝流程如下: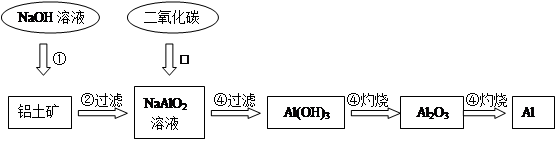
(1)請用離子方程式表示以上工藝流程中第①步反應:_______ _______。
(2)寫出以上工藝流程中第③步反應的化學方程式:______ ___________。
(3)金屬鋁與氧化鐵混合在高溫下,會發生劇烈的反應。該反應的化學方程式_____________。請舉一例該反應的用途________________。
(4)電解熔融氧化鋁制取金屬鋁,若有0.9mol電子發生轉移.理論上能得到金屬鋁的質量是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
將一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反應(假定容器不參與反應),試判斷下列情況下容器中金屬離子與金屬單質的存在情況:
(1)若Fe粉有剩余,則容器中不可能有____________
(2)若FeCl3有剩余,則容器中不可能有___________
(3)若CuCl2有剩余,則容器中還可能有________________________
(4)若FeCl3和CuCl2都有剩余,則容器中還可能有______________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氫氧化鈉溶液處理鋁土礦并過濾,得到含鋁酸鈉的溶液。向該溶液中通入二氧化碳,有下列反應: 2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
(1)上述五中物質中沸點最低物質的結構式為______________,由上述物質中的兩種元素按原子個數比1:1形成的離子化合物的電子式為__________________(寫一例)
(2)Al元素的單質有許多不同于其他金屬的特性,請列舉2例(也可以用化學方程式表示)
______________________、__________________________________.
(3)氫有3種穩定同位素,H氕、 D氘、 T氚,分別為豐度a、b、c,則計算氫元素的近似相對原子質量的表達式為______________________________________________.
甲認為H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同學認為H也可以與碳一樣,排在ⅣA族,乙同學的理由是__________________________________________________。
(4)己知通入二氧化碳336 L(標準狀況下),理論上生成Al(OH)3 ________________mol,
實際上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理論上要少的原因是:________________________________________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
聯堿法(候氏制堿法)和氨堿法的生產流程簡要表示如下圖: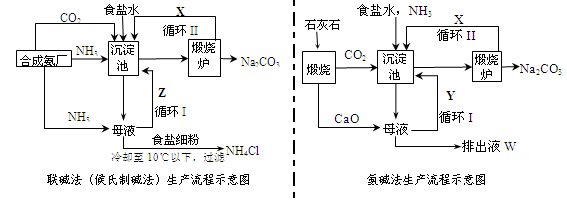
(1)兩種方法的沉淀池中均發生的反應化學方程式為_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液質量為54.00 kg,向該溶液通入二氧化碳至反應完全,過濾,得到濾液31.20kg,則NH4HCO3的產率為______________%。
(3)在氨堿法生產過程中氨要循環使用,但不需要補充,在母液中加生石灰前先要加熱的原因是 ___ 。
(4)根據聯堿法中從濾液中提取氯化銨晶體的過程推測,所得結論正確是_______(選填編號)。
a.常溫時氯化銨的溶解度比氯化鈉小
b.通入氨氣能增大NH4+的濃度,使氯化銨更多析出
c.加入食鹽細粉能提高Na+的濃度, 使NaHCO3結晶析出
d.通入氨氣能使NaHCO3轉化為Na2CO3,提高析出的NH4Cl純度
(5)聯堿法相比于氨堿法,氯化鈉利用率從70%提高到90%以上,主要是設計了循環Ⅰ,聯堿法的另一項優點是__________________________________________________。
(6)從沉淀池析出的晶體含有NaCl雜質,某同學在測定其NaHCO3的含量時,稱取5.000g試樣,配制成100mL溶液,用標準鹽酸溶液滴定(用甲基橙做指示劑),測定數據記錄如下:
| 滴定次數 | 待測液(mL) | 0.6000mol/L鹽酸溶液的體積(mL) | |
| 初讀數 | 終讀數 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右圖Ⅰ | 如右圖Ⅱ |
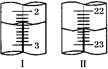 顯示消耗的鹽酸溶液體積為 。
顯示消耗的鹽酸溶液體積為 。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com