
【題目】鈷的化合物在工業生產、生命科技等行業有重要應用。
(1)Co2+的核外電子排布式為_______,Co的第四電離能比 Fe 的第四電離能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能與 CN一形成配位數為6的配離子。CN一中碳原子的雜化方式為____________;HCN分子中含有![]() 鍵的數目為__________________。
鍵的數目為__________________。
(3)用KCN處理含Co2+的鹽溶液 ,有紅色的Co(CN)2 析出,將它溶于過量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,該配離子是一種相當強的還原劑,在加熱時能與水反應生成[Co(CN )6]3-,寫出該反應的離子方程式:_______________。
(4)金屬鈷的堆積方式為六方最密堆積,其配位數是 _____。有學者從鈷晶體中取出非常規的“六棱柱”晶胞,結構如圖所示,該晶胞中原子個數為_____,該晶胞的邊長為a nm,高為c nm,該晶體的密度為___gcm-3(NA表示阿伏加德羅常數的值,列出代數式)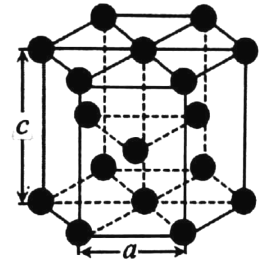
【答案】![]() 鈷原子失去4個電子后可以得到
鈷原子失去4個電子后可以得到![]() 的穩定結構,因此更容易失去第4個電子,表現為第四電離能較小 sp 2
的穩定結構,因此更容易失去第4個電子,表現為第四電離能較小 sp 2 ![]() 12 6
12 6 
【解析】
(1)鈷是27號元素,其電子排布為![]() ,再來分析即可;
,再來分析即可;
(2)碳原子最外層有4個電子,需要成4個鍵才能達到穩定結構,氮原子最外層有5個電子,需要成3個鍵才能達到穩定結構,而氫原子只能成1個鍵,據此不難推出![]() 的結構為
的結構為![]() ,再來分析其碳原子的雜化方式和
,再來分析其碳原子的雜化方式和![]() 鍵的數目即可;
鍵的數目即可;
(3)注意一個![]() 帶-1價,因此該反應的實質相當于鈷從+2價被氧化為+3價,水中自然只有氫能被還原,從+1價被還原為0價的單質;
帶-1價,因此該反應的實質相當于鈷從+2價被氧化為+3價,水中自然只有氫能被還原,從+1價被還原為0價的單質;
(4)根據觀察,每個鈷原子的配位數為12,即周圍一圈6個,上、下各3個,而晶體密度只需按照![]() 來構造公式即可。
來構造公式即可。
(1)鈷的電子排布式為![]() ,鈷原子失去4個電子后可以得到
,鈷原子失去4個電子后可以得到![]() 的穩定結構,因此更容易失去第4個電子,表現為第四電離能較小;
的穩定結構,因此更容易失去第4個電子,表現為第四電離能較小;
(2)![]() 為直線型分子,因此其碳原子的雜化方式為
為直線型分子,因此其碳原子的雜化方式為![]() 雜化,而1個
雜化,而1個![]() 分子中有2個
分子中有2個![]() 鍵和2個
鍵和2個![]() 鍵;
鍵;
(3)根據分析,反應方程式為![]() ;
;
(4)根據分析,鈷原子的配位數為12,在計算一個晶胞中的原子數時,12個頂點上的原子按![]() 算,上下表面面心的原子按
算,上下表面面心的原子按![]() 算,體內的按1個算,因此一個晶胞內一共有
算,體內的按1個算,因此一個晶胞內一共有![]() 個原子;而晶體密度為
個原子;而晶體密度為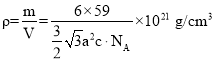 。
。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】下列有關電化學原理的說法正確的是
A.用惰性電極電解MgCl2飽和溶液可制得金屬鎂
B.用惰性電極電解CuCl2溶液時,陽極表面生成紅色物質
C.在鐵釘表面電鍍銅時,將鐵釘作陽極,銅作陰極,硫酸銅溶液為電解質
D.用石墨電極電解飽和食鹽水的過程中,溶液的pH逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鹵族元素組成的單質和化合物很多,我們可以利用所學物質結構與性質的相關知識去認識它們。
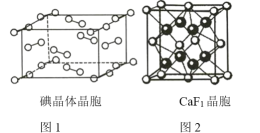
①如圖1為碘晶體的晶胞結構。有關說法正確的是_________(填序號)。
a.平均每個晶胞中有4個碘分子
b.平均每個晶胞中有4個碘原子
c.碘晶體為無限延伸的空間結構,是原子晶體
d.碘晶體中存在的相互作用有非極性鍵和范德華力
②已知CaF2晶胞(圖2)的密度為ρ g/cm3,NA表示阿伏加德羅常數的值,棱上相鄰的兩個Ca2+的核間距為a cm,則CaF2的摩爾質量可表示為_________________。
(2)以MgCl2為原料用電解熔融鹽法制備鎂時,常加入NaCl、KCl或CaCl2等金屬氯化物,其主要作用除了降低熔點之外,還有_______________。
(3)有研究表明,化合物X可用于研究模擬酶,當結合 或Cu(I)(I表示化合價為+1)時,分別形成如下圖所示的A和B:
或Cu(I)(I表示化合價為+1)時,分別形成如下圖所示的A和B:

①A中連接相鄰含N雜環的碳碳鍵可以旋轉,說明該碳碳鍵具有_________鍵的特性。
②微粒間的相互作用包括化學鍵和分子間相互作用,比較A和B中微粒間相互作用力的差異:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛鉻黃是一種顏料,主要成分是鉻酸鉛PbCrO4。現以CrCl36H2O 和 Pb(NO 3)2等為原料制備該物質,并測定產物純度。
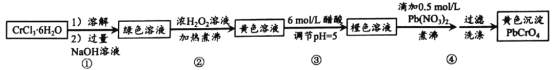
(1)溶解、過濾、洗滌操作時, 均需要用到的以下儀器為______________(填標號)。

(2)第①步所得綠色溶液的主要成分為 NaCrO2,已知 Cr(OH)3 不溶于水,與Al(OH)3類似,具有兩性。寫①步發生反應的離子方程式_____________________。
(3)第②步中加入H2O2 濃溶液的目的是___________________。溶液逐步變為亮黃色后,仍須持續煮沸溶液一段時間,目的是_____________________。
(4)第③步加入醋酸的目的是,防止pH 較高時,加入 Pb(NO3)2 溶液會產生______(填化學式)沉淀,影響產率。利用pH 試紙,調節 pH 的實驗操作是_____________。pH逐步降低時, 溶液中的CrO42-轉化為 ____________離子(填化學式)。
(5)由于鉻酸鉛的溶解度比重鉻酸鉛的小的多,在第④ 步中逐滴滴加 Pb(NO3)2溶液后,產PbCrO4黃色沉淀, 此時為了提高鉛鉻黃的產率,可補加少量NaOH溶液,請用化學平衡移動原理加以解釋:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得到的結論正確的是( )
選項 | 實驗操作和現象 | 結 論 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固體,溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
B | 用鉑絲蘸取少量NaCl溶液進行焰色反應,火焰呈黃色 | 這是鈉離子的發射光譜 |
C | NaI溶液 | 酸性條件下H2O2的氧化性比I2強 |
D | 向濃度均為0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出現黃色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為0.1 mol/L體積均為V0的HA、HB溶液分別加水稀釋至體積為 V的溶液。稀釋過程中,pH與![]() 的變化關系如圖所示。下列敘述正確的是
的變化關系如圖所示。下列敘述正確的是
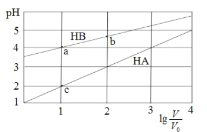
A.pH 隨 ![]() 的變化始終滿足直線關系
的變化始終滿足直線關系
B.溶液中水的電離程度:a > b > c
C.該溫度下,Ka(HB)≈ 10-6
D.分別向稀釋前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 時,c(A-)= c(B-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中,給一氧化碳和水蒸氣的氣體混合物加熱,在催化劑存在下發生反應:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃時,平衡常數K=9。若反應開始時,一氧化碳和水蒸氣的濃度都是0.02 mol/L,則在此條件下CO的轉化率為( )
H2(g)+CO2(g)。在500 ℃時,平衡常數K=9。若反應開始時,一氧化碳和水蒸氣的濃度都是0.02 mol/L,則在此條件下CO的轉化率為( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CPAE是蜂膠的主要活性成分,也可由咖啡酸合成,下列說法不正確的是( )

A. 1mol CPAE與足量的溴水反應,最多消耗4mol Br2
B. 咖啡酸可發生聚合反應,而且其分子中含有3種官能團
C. 與苯乙醇互為同分異構體的酚類物質共有9種
D. 可用金屬Na檢測上述反應是否殘留苯乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物的結構簡式如圖所示,下列有關該物質的說法正確的是( )
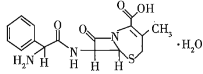
A.在一定條件下,該物質能發生水解反應生成氨基酸
B.1 mol該物質最多能與7 mol H2發生加成反應
C.該物質能與碳酸鈉反應,不能與鹽酸反應
D.該物質不能使溴水褪色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com