
【題目】某學習小組以Mg(NO3)2為研究對象,擬通過實驗初步探究硝酸鹽熱分解的規律.
(提出猜想)小組提出如下4種猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查閱資料得知,NO2可被NaOH溶液吸收,反應的化學方程式為:____________.
(2)實驗前,小組成員經討論認定猜想丁不成立,理由是____________.
(實驗操作)
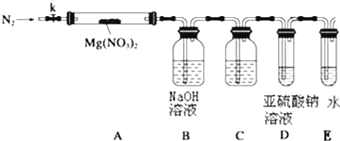
(3)設計如圖裝置,用氮氣排盡裝置中空氣,其目的是___________;加熱Mg(NO3)2固體,AB裝置實驗現象是:____________,說明有Mg(NO3)2固體分解了,有NO2生成.
(4)有同學提出可用亞硫酸鈉溶液檢驗是否有氧氣產生,但通入之前,還需在BD裝置間增加滴有酚酞的氫氧化鈉溶液,其作用是:____________
(5)小組討論后認為即便通過C后有氧氣,僅僅用亞硫酸鈉溶液仍然難以檢驗,因為:____________,改進的措施是可在亞硫酸鈉溶液中加入____________.
(6)上述系列改進后,如果分解產物中有O2存在,排除裝置與操作的原因,未檢測到的原因是____________.(用化學方程式表示)
【答案】2NO2+2NaOH=NaNO3+NaNO2+H2O 不符合氧化還原反應原理 避免對產物O2的檢驗產生干擾(或其它合理答案 固體減少,產生紅棕色氣體,溶液中有氣泡冒出 確保二氧化氮已被除盡,防止干擾氧氣的檢驗 亞硫酸鈉溶液與氧氣反應沒有明顯現象,難以判斷反應是否發生了 幾滴酚酞試劑 4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O
【解析】
(1)NO2在堿性條件下自身發生氧化還原反應,與氫氧化鈉反應生成NaNO3和NaNO2;
(2)根據氧化還原反應化合價升降相等判斷;
(3)為檢驗是否生成氧氣,應將裝置內的氧氣排盡;加熱Mg(NO3)2固體,固體質量減小,如生成紅棕色氣體,則有NO2生成;
(4)亞硫酸鈉具有還原性,可被氧氣氧化,也可被二氧化氮氧化;
(5)亞硫酸鈉溶液與氧氣反應沒有明顯現象,結合亞硫酸鈉溶液呈堿性,硫酸鈉溶液呈中性判斷;
(6)如果分解產物中有O2存在,但沒有檢測到,可能原因是二氧化氮、氧氣與水反應。
(1)NO2在堿性條件下自身發生氧化還原反應,與氫氧化鈉反應生成NaNO3和NaNO2,反應的方程式為2NO2+2NaOH=NaNO3+NaNO2+H2O;
(2)由于丁產物中化合價只有降低情況,沒有升高,不滿足氧化還原反應的特征,不符合氧化還原反應原理;
(3)為檢驗是否生成氧氣,應將裝置內的氧氣排盡,避免對產物O2的檢驗產生干擾,加熱Mg(NO3)2固體,固體質量減小,如生成紅棕色氣體,則有NO2生成;
(4)亞硫酸鈉具有還原性,可被氧氣氧化,也可被二氧化氮氧化,通入之前,還需在BD裝置間增加滴有酚酞的氫氧化鈉溶液,可確保二氧化氮已被除盡,防止干擾氧氣的檢驗;
(5)亞硫酸鈉溶液與氧氣反應沒有明顯現象,結合亞硫酸鈉溶液呈堿性,硫酸鈉溶液呈中性判斷,可滴加幾滴酚酞試劑,如溶液由紅色變為無色,說明有氧氣生成;
(6)如果分解產物中有O2存在,但沒有檢測到,可能原因是二氧化氮、氧氣與水反應,發生方程式為4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O。


科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理(平衡移動原理)解釋的是
①溴水中存在化學平衡:Br2+H2O ![]() HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺
HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺
②鐵在潮濕的空氣中易生銹
③二氧化氮與四氧化二氮的平衡體系,增大壓強后顏色加深
④合成氨反應,為提高氨的產率,理論上應采取降低溫度的措施
⑤鈉與氯化鉀共融制備鉀:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④B.③④C.②⑤D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對常溫下0.1mol/L的醋酸溶液,以下說法正確的是
A.由水電離出來的c(H+)=1.0×10-13mol/L
B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.與同濃度的鹽酸分別加水稀釋10倍:pH(醋酸) <pH(鹽酸)
D.與等濃度等體積NaOH溶液反應后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下的可逆反應CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。下列說法正確的是( )
CH3OH(g) △H <0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。下列說法正確的是( )
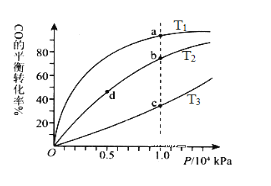
A.溫度:T1< T2 <T3
B.正反應速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常數: K(a) =K(c) ;K(b) >K(d)
D.平均摩爾質量:M(a)<M(c);M(b)>M(d)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】700℃時,H2(g)+CO2(g)![]() H2O(g)+CO(g)。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2和CO2,起始濃度如下表所示。其中甲經2min達平衡時,v(H2O)為0.025 mol/(L·min),下列判斷不正確的是()
H2O(g)+CO(g)。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2和CO2,起始濃度如下表所示。其中甲經2min達平衡時,v(H2O)為0.025 mol/(L·min),下列判斷不正確的是()
起始濃度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡時,乙中CO2的轉化率大于50%
B. 當反應平衡時,丙中c(CO2)是甲中的2倍
C. 溫度升至800℃,上述反應平衡常數為25/16,則正反應為吸熱反應
D. 其他條件不變,若起始時向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到達平衡時c (CO)與乙不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某溫度下AgCl(s)的溶度積常數Ksp=1×10-10。在該溫度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的鹽酸,生成沉淀(混合后溶液的體積變化忽略不計)。下列說法正確的是()
A.AgCl的溶解性為難溶,則該物質不溶于水
B.沉淀生成后,溶液中Ag+的濃度1×10-5mol/L
C.沉淀生成后,溶液中NO3-的濃度1.8×10-2mol/L
D.沉淀生成后,溶液的pH為2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩燒杯中分別盛有100mL 3mol/L的硫酸和NaOH溶液,向兩燒杯中各加入等質量的鋁粉,反應結束后測得生成的氣體體積比為甲︰乙=2︰3,則加入鋁粉的質量為
A.5.4gB.7.2gC.8.1gD.10.8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是五種主族元素的結構特點及其元素、單質、化合物的性質.
元素 | 結構特點及元素、單質、化合物的性質 |
X | 氣態氫化物與最高價氧化物對應水化物可以化合成鹽 |
Y | 原子中s電子數與p電子數相同,且p電子的能量最高 |
Z | 單質在空氣中燃燒產生黃色火焰,生成黃色粉末 |
W | 最外層電子排布(n+1)sn(n+1)pn﹣1 |
T | 單質升華可以產生紫色的煙 |
(1)寫出X元素的原子核外電子排布__;其單質的化學性質__(填“穩定”或“活潑”),該元素的非金屬性__(填“強”或“弱”),證明其強弱的理由是__.
(2)Z單質在空氣中燃燒生成黃色粉末,寫出該物質的電子式__;已知w的氯化物在177.8°C時會發生升華現象,由此可以判斷它的晶體類型為__.
(3)W的最高價氧化物對應水化物可以與X、Z的最高價氧化物對應水化物反應,寫出反 應的離子方程式:__,__.
(4)一種元素有多種可變價態,一般高價氧化物對應水化物成酸,低價氧化物對應水化物成堿.Y、T可形成多種化合物,其中T元素的化合價為+3、+5時,形成的化合物的化學式為__.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對乙酰氨基苯酚X是常用的非甾類消炎解熱鎮痛藥。可用如下路線來合成:
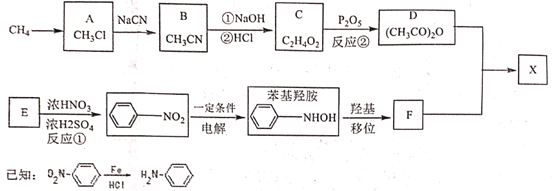
請回答下列問題:
(1)下列說法正確的是:_____________
A 反應①②皆為取代反應 B 有機物D能與水反應生成C
C F既能與強酸反應又能與強堿反應 D X分子中含有酚羥基和肽鍵兩種官能團
(2)X與足量氫氧化鈉反應的化學方程式:_____________。
(3)分析F分子結構特點和X合成原理后,認為制得X中有某種副產物,請寫出該副產物的結構簡式:___
(4)寫出同時滿足下列條件的X的所有同分異構體的結構簡式:__________
①分子中含有-NH2;
②與氯化鐵溶液發生顯色反應;
③苯環上的取代基不超過3個且苯環上只有兩種不同環境的H
(5)請設計以甲苯為原料合成![]() 的路線(用流程圖表示,無機物任選)__________
的路線(用流程圖表示,無機物任選)__________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com