
【題目】甲、乙兩燒杯中分別盛有100mL 3mol/L的硫酸和NaOH溶液,向兩燒杯中各加入等質量的鋁粉,反應結束后測得生成的氣體體積比為甲︰乙=2︰3,則加入鋁粉的質量為
A.5.4gB.7.2gC.8.1gD.10.8g
【答案】CD
【解析】
由化學反應方程式2Al+3H2SO4═Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,等量的鋁與足量的硫酸和氫氧化鈉溶液反應,生成的氣體體積比為甲:乙=1:1;足量的鋁與等物質的量的硫酸和氫氧化鈉溶液反應,生成的氣體體積比為甲:乙=2:3;
根據鋁的質量相同,硫酸和氫氧化鈉溶液中溶質的物質的量均為0.3mol,反應結束后測得生成的氣體體積比為甲:乙=2:3來計算解答。
硫酸和氫氧化鈉溶液中溶質的物質的量均為0.1L×3mol/L=0.3mol,又兩燒杯中分別加入等質最的鋁粉,反應結束后測得生成的氣體體積比為甲:乙=2:3,
設鋁與酸反應時酸完全反應,生成的氫氣的物質的量為x,
則 2Al+3H2SO4═Al2(SO4)3+3H2↑
3 3
0.3mol x
解得x=0.3mol,
一定條件下,氣體的物質的量之比等于體積之比,則堿與金屬鋁反應生成的氫氣的物質的量為0.3mol×![]() =0.45mol,
=0.45mol,
堿與金屬鋁反應時鋁完全反應,設與堿反應的鋁的物質的量為y,
則 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
Y 0.45mol
解得y=![]() =0.3mol,
=0.3mol,
則鋁的質量為0.3mol×27g/mol=8.1g,故C正確;
足量的鋁與等物質的量的硫酸和氫氧化鈉溶液反應,生成的氣體體積比為甲:乙=2:3,故D正確;
故選CD。


 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:
【題目】查爾酮類化合物![]() (
(![]() )的一種合成路線如下:
)的一種合成路線如下:

已知:![]()
回答下列問題:
(1)![]() 的名稱為_______,
的名稱為_______,![]() 的官能團名稱為_____________。
的官能團名稱為_____________。
(2)![]() 的分子式為_____________________。
的分子式為_____________________。
(3)![]() 的反應類型為____________________。
的反應類型為____________________。
(4)![]() 的反應方程式為_________________。
的反應方程式為_________________。
(5)M是E的同分異構體,滿足下列條件,其中核磁共振氫譜有4組吸收峰,峰面積之比為![]() 的結構為__________________。
的結構為__________________。
①能發生水解反應 ②遇![]() 顯色
顯色
(6)參照上述合成路線,寫出用苯乙烯與苯甲醛為原料制備查爾酮(![]() )的合成路線(其他試劑任選)。________________
)的合成路線(其他試劑任選)。________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將a L NH3通入某恒壓的密閉容器中,在一定條件下讓其分解,達到平衡后氣體體積增大到b L(氣體體積在相同條件下測定)。下列說法中正確的是( )
A.平衡后氨氣的分解率為![]()
B.平衡混合氣體H2的體積分數為![]()
C.反應前后氣體的密度比為![]()
D.平衡后氣體的平均摩爾質量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組以Mg(NO3)2為研究對象,擬通過實驗初步探究硝酸鹽熱分解的規律.
(提出猜想)小組提出如下4種猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查閱資料得知,NO2可被NaOH溶液吸收,反應的化學方程式為:____________.
(2)實驗前,小組成員經討論認定猜想丁不成立,理由是____________.
(實驗操作)
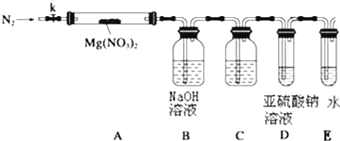
(3)設計如圖裝置,用氮氣排盡裝置中空氣,其目的是___________;加熱Mg(NO3)2固體,AB裝置實驗現象是:____________,說明有Mg(NO3)2固體分解了,有NO2生成.
(4)有同學提出可用亞硫酸鈉溶液檢驗是否有氧氣產生,但通入之前,還需在BD裝置間增加滴有酚酞的氫氧化鈉溶液,其作用是:____________
(5)小組討論后認為即便通過C后有氧氣,僅僅用亞硫酸鈉溶液仍然難以檢驗,因為:____________,改進的措施是可在亞硫酸鈉溶液中加入____________.
(6)上述系列改進后,如果分解產物中有O2存在,排除裝置與操作的原因,未檢測到的原因是____________.(用化學方程式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法中正確的是()
A.Ksp(AB2)<Ksp(CD),說明AB2的溶解度小于CD的溶解度
B.在ZnS的沉淀溶解平衡體系中加入蒸餾水,ZnS的Ksp增大
C.AgCl分別在同濃度的CaCl2溶液和NaCl溶液中溶解度不同
D.在CaCO3的沉淀溶解平衡體系中加入稀鹽酸,沉淀溶解平衡不移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)100°C時,KW=1.0×10-12,在該溫度下,測得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的電離方程式為_____;
②體積相等pH=1的鹽酸與H2A溶液分別與足量的Zn反應,H2A溶液產生的H2_____(填“多”、“少”或“一樣多”)。
(2)將0.4mol/L HA溶液與0.2mol/L NaOH溶液等體積混合,測得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常溫下測得濃度均為0.1mol/L的下列5種溶液的pH,如表所示:
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的離子方程式_____;
②濃度均為0.01mol/L的下列4種物質的溶液分別加水稀釋100倍,pH變化最小的是_____(填編號);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常溫下濃度相同的醋酸和醋酸鈉混合液pH=6,則c(CH3COO-)-c(CH3COOH)=_____mol/L(填準確數值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香化合物A(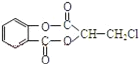 )在一定條件下可以發生如圖所示的轉化(其他產物和水已略去)。
)在一定條件下可以發生如圖所示的轉化(其他產物和水已略去)。
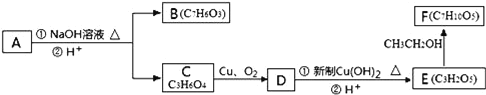
請回答下列問題:
(1)請寫出A中包含的官能團的名稱:__。
(2)有機物C可以由乳酸經過幾步有機反應制得,其中最佳的次序是__。
A.消去、加成、水解、酸化 B.氧化、加成、水解、酸化
C.取代、水解、氧化、酸化 D.消去、加成、水解、氧化
(3)寫出由E制得F的化學方程式:__。
(4)1molA在氫氧化鈉溶液中加熱,充分反應消耗氫氧化鈉__mol,寫出該反應的化學方程式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①在稀堿溶液中,溴苯難發生水解
②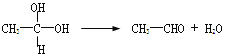
③苯酚與濃溴水反應,只有鄰、對位上的氫被取代
現有分子式為C10H10O2Br2的芳香族化合物X,其苯環上有四個取代基且苯環上的一溴代物只有一種,其在一定條件下可發生下述一系列反應,其中C能發生銀鏡反應,E遇FeCl3溶液顯色且能與濃溴水反應。
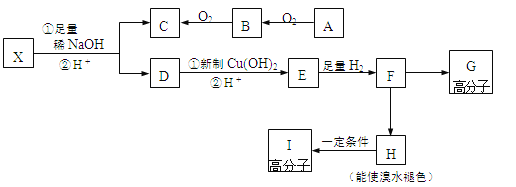
請完成下列填空:
47、寫出B的電子式________;F→H的反應類型是________反應。
48、寫出A→B的化學方程式_________________________。
49、X的結構簡式為__________。
50、下列關于E的描述正確的是___(選填序號)
a.能發生酯化反應 b.含有4種不同化學環境的氫原子
c.與C互為同系物 d.1mol E最多能與2mol NaHCO3作用
51、寫出F→G的化學方程式:_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二氯乙烷是一種廣泛使用的有機溶劑、黏合劑,也用作谷物和糧倉的熏蒸劑,沸點83.5℃,熔點-35℃。某研究性學習小組的同學利用如圖(加熱裝置省略)裝置制備一定量的1,2-二氯乙烷,制備原理為:C2H5OH![]() C2H4→CH2ClCH2Cl。裝置A中的濃硫酸是催化劑、脫水劑,乙醇的密度約為0.8g/mL 。
C2H4→CH2ClCH2Cl。裝置A中的濃硫酸是催化劑、脫水劑,乙醇的密度約為0.8g/mL 。
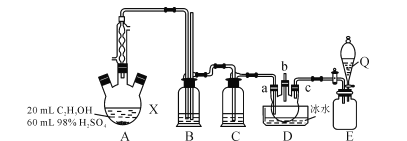
(1)根據制備原理,可知裝置A中還缺少的一種實驗儀器是________。使用冷凝管的目的是__________________________。
(2)實驗時A中三頸燒瓶內有有刺激性氣味的無機氣體產生,為吸收反應中生成的無機氣體,在裝置B中應加入________(填字母序號)。
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(3)D中a、c兩個導管進入儀器中的長度不同,其優點是________________,對導管b的進一步處理方法是______________________,裝置E是氯氣的貯氣瓶,則Q中的物質是______________。
(4)若得到ag1,2-二氯乙烷,則乙醇的利用率為_____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com