
【題目】向一個固定體積的密閉容器充入 2mol A 和 1mol B,發生如下反應:2A(g)+B(g) 3C(g)+D(g),2 分鐘后,反應達到平衡,C 的濃度為 1.2mol/L。
(1)用 A 表示 2 分鐘內平均反應速率為_____,A 在第 1 分鐘平均速率_______第 2分鐘平均速率(填“<”、“>”、“=”)。
(2)容器溫度升高,平衡時混合氣體的平均相對分子質量減小,則正反應為_____(填“吸熱”或“放熱”)反應.
(3)增大 B 的轉化率,可采取的措施是_____(用序號填空)
①加入 A ②加入 B ③加壓④再加入 1.6mol A+0.8mol B ⑤將 C 分離出容器
(4)若在相同條件下,在上述容器中充入 1.5mol C 和 0.5mol D 發生上述反應,為使平衡后,C 的濃度仍為 1.2mol/L,則應再充入_____molA 和_____molB.
(5)若在一體積可變的容器中,該反應達到平衡時,由于條件改變而引起反應速率和化學平衡的變化情況如下圖,a 點改變的條件可能是_____;b 點改變的條件可能是_____;若升高溫度時,請將反應速率變化情況畫在 c-d 處。_____________

【答案】0.4mol/(Lmin) > 吸熱 ①⑤ 1 0.5 增大壓強 分離C或D 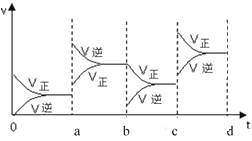
【解析】
(1)C的濃度變化值為1.2mol/L,可知C的速率為0.6 mol/(Lmin),v(A):v(C)=2:3,所以v(A)=0.4mol/(Lmin),隨反應進行A的濃度逐漸減小,所以A 在第 1 分鐘平均速率大于第 2分鐘平均速率;
(2)容器溫度升高,平衡時混合氣體的平均相對分子質量減小,說明平衡向氣體分子數多的方向移動,即正向移動,所以正向為吸熱反應;
(3)①⑤可以使平衡正向移動,增大 B 的轉化率,②加入B雖然促進正向反應,但是B 的轉化率減小,③加壓會引起平衡逆向移動,B 的轉化率減小,④再加入 1.6mol A和0.8mol B,A與B的比例與原始比例相同,均為2:1,所以該改變相當于加壓,使平衡逆向移動,B 的轉化率減小,滿足題意的是①⑤;
(4)該題為絕對等效平衡,需要與初始A和B的濃度相等,根據“一邊倒”,可得充入 1.5mol C 和 0.5mol D等效于充入 1mol A 和 0.5mol B,要達到C 的濃度仍為 1.2mol/L的要求,再充入 1mol A 和 0.5mol B;
(5)a點處平衡逆向移動,速率增大,且前后圖像斷開,可能條件為增大壓強,b點處平衡正向移動,速率減小,且前后圖像連接,可能條件是分離出C或D。升高溫度,正逆反應速率都增大,平衡正向移動,故圖像為: 。
。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】已知A(g)+2B(g)![]() C(g)+4D(g) ΔH=+Q kJ·mol-1(Q>0)。某溫度壓強下,在密閉容器進行上述反應,下列敘述正確的是( )
C(g)+4D(g) ΔH=+Q kJ·mol-1(Q>0)。某溫度壓強下,在密閉容器進行上述反應,下列敘述正確的是( )
A.反應過程中,若壓縮體積增大壓強能提高A的轉化率
B.若反應開始時A為1 mol,則達到平衡時吸收的熱量為Q kJ
C.反應至4 min時,若D濃度為0.12 mol·L-1,則B的反應速率為0.03 mol·L-1·min-1
D.反應吸收0.025Q kJ熱量時,生成的D的物質的量為0.1 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗室廢液含![]() 、Na+、Fe3+、Cr3+、
、Na+、Fe3+、Cr3+、![]() 、
、![]() 等離子,現通過如下流程變廢為寶制備K2Cr2O7。
等離子,現通過如下流程變廢為寶制備K2Cr2O7。

已知:
(a)![]() ;
;![]()
(b)金屬離子形成氫氧化物沉淀的pH范圍如表。
金屬離子 | pH | |
開始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
請回答:
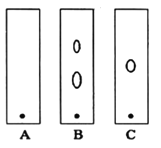
(1)某同學采用紙層析法判斷步驟①加入KOH的量是否合適。在加入一定量KOH溶液后,用毛細管取樣、點樣、薄層色譜展開、氨熏后的斑點如圖所示。加入KOH最適合的實驗編號是(實驗順序已打亂)________,C的斑點顏色為________。
(2)步驟②含Cr物質發生的主要反應的離子方程式為________________________。
(3)在下列裝置中,②應選用________。(填標號)
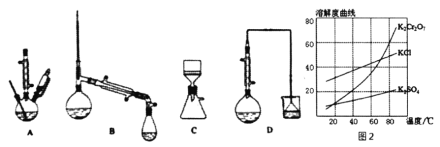
(4)部分物質的溶解度曲線如圖2,步驟⑤可能用到下列部分操作:a.蒸發至出現大量晶體,停止加熱;b.冷卻至室溫;c,蒸發至溶液出現晶膜,停止加熱;d.洗滌;e.趁熱過濾;f.抽濾。請選擇合適操作的正確順序________。
(5)步驟⑤中合適的洗滌劑是________(“無水乙醇”、“乙醇-水混合液”、“熱水”、“冰水”)。
(6)取mg粗產品配成250mL溶液,取25.00mL于錐形瓶中,用cmol·L-1的(NH4)2Fe(SO4)2標準溶液滴定(雜質不反應),消耗標準(NH4)2Fe(SO4)2溶液VmL,則該粗產品中K2Cr2O7的純度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有7瓶失去標簽的試劑瓶,已知它們盛裝的液體可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。現通過如下實驗來確定各試劑中所裝液體的名稱。
實驗步驟和方法 | 實驗現象 |
①把7瓶液體依次標號為A、B、C、D、E、F、G后聞氣味 | 只有F、G兩種液體沒有氣味 |
②各取少量于試管中加水稀釋 | 只有C、D、E三種液體不溶解而浮在水上層 |
③分別取少量7種液體于試管中加新制的 | 只有B使沉淀溶解,F中產生磚紅色沉淀 |
④各取C、D、E少量于試管中,加稀 | 只有C中仍有分層現象,且在D的試管中聞到特殊香味 |
(1)試寫出下列序號代表的液體名稱:
A________,B________,C_______,D_______,E______,F______,G________。
(2)寫出在D中加入![]() 溶液并加熱的化學方程式:_______。
溶液并加熱的化學方程式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】50mL 1.0molL-1 鹽酸跟 50mL 1.1molL-1 氫氧化鈉溶液在圖 1 裝置中進行中和反應,并通過測定反應過程中所放出的熱量來計算中和熱。試回答下列問題:

(1)寫出該反應的中和熱熱化學方程式:___________。
(2)___________(填“能”或“不能”)將環形玻璃攪拌棒改為環形銅棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 鹽酸跟 50mL 1.1molL-1 氫氧化鈉溶液進行反應,則與上述實驗相比,所放熱量_____(“增加”、“減少”或“不變”),所求中和熱數值_____(“增加”、“減少”或“不變”)。
(4)某研究小組將裝置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知濃度的 NaOH 溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖 2 所示(實驗中始終保持 V1+V2 = 50mL)。回答下列問題:研究小組做該實驗時環境溫度_________(填“高于”、“低于”或“等于”)22℃。
(5)①請填寫下表中的空白:
溫度 實驗次數 | 起始溫度 t1℃ | 終止溫度 t2/℃ | 溫度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似認為 50mL 1.0molL-1 鹽酸跟 50mL 1.1molL-1 氫氧化鈉溶液的密度都是 1 g/cm3,中和后生成溶液的比熱容 c=4.18 J/(g·℃)。則中和熱Δ H=_________( 取小數點后一位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應C(s)+H2O(g)![]() CO(g)+H2(g)在一可變容積的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
CO(g)+H2(g)在一可變容積的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
①增加C的量 ②將容器的體積縮小一半 ③保持體積不變,充入N2使體系壓強增大 ④保持壓強不變,充入N2使容器體積變大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以淀粉為基本原料可制備許多物質,如:

下列有關說法中正確的是
A.淀粉是糖類物質,有甜味,與纖維素互為同分異構體
B.反應③是消去反應,反應④是加聚反應,反應⑤是氧化反應
C.乙烯、聚乙烯分子中均含有碳碳雙鍵,均可被酸性KMnO4溶液氧化
D.反應②是葡萄糖發生水解生成了CH3CH2OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均為C6H6,下列說法正確的是
的分子式均為C6H6,下列說法正確的是
A. b的同分異構體只有d和p兩種B. b、d、p的二氯代物均只有三種
C. b、d、p均可與酸性高錳酸鉀溶液反應D. b、d、p中只有b的所有原子處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,![]() 二氯丙烷
二氯丙烷![]() 是一種重要的化工原料,工業上可用丙烯加成法制備,主要副產物為
是一種重要的化工原料,工業上可用丙烯加成法制備,主要副產物為![]() 氯丙烯
氯丙烯![]() ,反應原理為:
,反應原理為:
Ⅰ![]()
![]() CH2ClCHClCH3(g) H1= -134KJ/mol-1
CH2ClCHClCH3(g) H1= -134KJ/mol-1
Ⅱ![]()
![]() CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
請回答下列問題:
![]() 已知
已知![]()
![]()
![]() 的活化能
的活化能![]() 正
正![]() 為132KJ/mol-1,則該反應的活化能
為132KJ/mol-1,則該反應的活化能![]() 逆
逆![]() 為__________ KJ/mol-1。
為__________ KJ/mol-1。
![]() 一定溫度下,向恒容密閉容器中充入等物質的量的
一定溫度下,向恒容密閉容器中充入等物質的量的![]() 和
和![]() ,在催化劑作用下發生反應Ⅰ、Ⅱ,容器內氣體的壓強隨時間的變化如下表所示。
,在催化劑作用下發生反應Ⅰ、Ⅱ,容器內氣體的壓強隨時間的變化如下表所示。
時間 | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強 | 80 |
|
|
|
|
|
|
①若用單位時間內氣體分壓的變化來表示反應速率,即ν=![]() ,則前
,則前![]() 內平均反應速率ν(CH2ClCHClCH3)=__________kPamin-1(保留小數點后2位
內平均反應速率ν(CH2ClCHClCH3)=__________kPamin-1(保留小數點后2位![]() 。
。
②該溫度下,若平衡時HCl的體積分數為![]() ,則丙烯的平衡總轉化率α=__________;反應Ⅰ的平衡常數
,則丙烯的平衡總轉化率α=__________;反應Ⅰ的平衡常數![]() ________
________![]() 為以分壓表示的平衡常數,保留小數點后2位
為以分壓表示的平衡常數,保留小數點后2位![]() 。
。
![]() 某研究小組向密閉容器中充入一定量的
某研究小組向密閉容器中充入一定量的![]() 和
和![]() ,分別在A、B兩種不同催化劑作用下發生反應,一段時間后測得
,分別在A、B兩種不同催化劑作用下發生反應,一段時間后測得![]() 的產率與溫度的關系如圖所示。
的產率與溫度的關系如圖所示。

下列說法錯誤的是____________![]() 填代號
填代號![]() 。
。
![]() 使用催化劑A的最佳溫度約為250℃
使用催化劑A的最佳溫度約為250℃
![]() 相同條件下,改變壓強會影響
相同條件下,改變壓強會影響![]() 的產率
的產率
c.![]() 點是對應溫度下
點是對應溫度下![]() 的平衡產率
的平衡產率
![]() 提高
提高![]() 反應選擇性的關鍵因素是控制溫度
反應選擇性的關鍵因素是控制溫度
(4)在四個恒容密閉容器中充入相應量的氣體(如圖):

發生反應2N2O(g)![]() 2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡轉化率如圖所示:
2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡轉化率如圖所示:

容器II、Ⅳ的體積為1L,容器Ⅳ中的物質也在470℃下進行反應,起始反應速率:
①![]() 正(N2O)____逆(N2O)。(填“>”“<”或“=”)
正(N2O)____逆(N2O)。(填“>”“<”或“=”)
②圖中A、B、C三點處容器內密度最大的點是____(填“A”“B”或“C”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com