
【題目】在![]() 某一元堿(
某一元堿(![]() )中,滴加入
)中,滴加入![]() 的醋酸溶液,滴定曲線如圖所示。下列說法錯誤的是( )
的醋酸溶液,滴定曲線如圖所示。下列說法錯誤的是( )
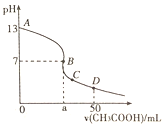
A.該堿溶液可以溶解![]()
B.![]() 點對應的體積大于
點對應的體積大于![]()
C.![]() 點時,
點時,![]()
D.![]() 點時,
點時,![]()
【答案】D
【解析】
A. 由A點知:0.1molL1一元堿的pH=13可得,該堿為強堿,所以該堿溶液可以溶解![]() ,故A正確;
,故A正確;
B. 恰好中和時生成強堿弱酸鹽pH應大于7,而B點pH=7,所以該點對應的溶質為CH3COOY和CH3COOH,a點的體積大于25mL,故B正確;
C. C點對應的溶質為CH3COOY和CH3COOH,溶液中CH3COOY的濃度>CH3COOH的濃度,因pH<7,所以c(H+)>c(OH),弱酸的電離是微弱的,結合電荷守恒c(CH3COO)+c(OH)=c(H+)+c(Y+),則應有c(CH3COO)>c(Y+)> c(H+)>c(OH),故C正確;
D. D點為CH3COOY和CH3COOH等物質的量濃度的混合液,根據物料守恒c(CH3COO)+c(CH3COOH)=2c(Y+)和電荷守恒c(CH3COO)+c(OH)=c(H+)+c(Y+),所以應有![]() ,故D錯誤;
,故D錯誤;
答案選D。


科目:高中化學 來源: 題型:
【題目】某班幾個興趣小組做了以下實驗。
甲組:兩同學利用下列試劑:鐵粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性質,設計實驗方案進行實驗,完成下列表格。
探究內容 | 實驗方案 | 實驗現象 | 寫出離子方程式 |
①探究Fe2+具有還原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不變紅,后變為血紅色。 | Fe2+發生的反應: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振蕩,靜置,再往溶液中加入少量KSCN溶液。 | 溶液不變為血紅色。 | Fe3+發生的反應:________ |
乙組:兩同學利用下圖所示的裝置進行鐵與水蒸氣反應的實驗,并繼續研究鐵及其化合物的部分性質。
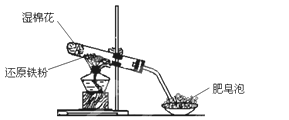
請回答下列問題。
(1)硬質試管中發生反應的化學方程式為_______________。
(2)欲確定反應后硬質試管中固體物質的成分,實驗過程如下:
①待硬質試管冷卻后,取少許其中的固體物質溶于足量稀硫酸得溶液B;
②取少量溶液B于試管a中,滴加KSCN溶液,溶液沒有變紅色,則溶液B中的陽離子有_________________,硬質試管中固體物質的成分是_________________。
(3)另取少量溶液B,使其與NaOH溶液反應(按圖所示),在膠頭滴管擠出NaOH溶液的瞬間可觀察到生成白色沉淀,沉淀迅速變成灰綠色,最后變成紅褐色。請寫出與上述現象中白色沉淀轉化紅褐色沉淀的化學方程式________________。
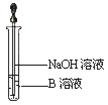
(4)一段時間后,發現a中未變紅的溶液變成紅色,原因是 _______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從甜橙的芳香油中可分離得到如圖結構的化合物,
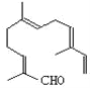
現有試劑:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能與該化合物中所有官能團都發生反應的試劑有( )
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學欲除去固體氯化鈉中混有的氯化鈣,請據如下實驗方案回答問題。
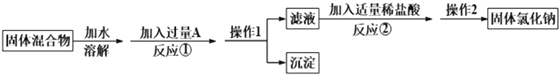
(1)操作1的名稱是_____;
(2)反應①中加入略過量的A物質的目的是__________;
(3)寫出反應②的化學方程式:_______。
(4)實驗時稱取樣品的質量為185.0g,經過操作1后,測得沉淀(不溶于水)的質量為50.0g, 則樣品中NaCl的質量分數是多少___?(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中,屬于烴的衍生物的是
①CH4 ②CH2=CH2 ③CH ![]() CH ④CH3CH2OH ⑤CH3CHO、⑥CH3COOH ⑦CH3COOCH2CH3⑧CH3CH2Cl
CH ④CH3CH2OH ⑤CH3CHO、⑥CH3COOH ⑦CH3COOCH2CH3⑧CH3CH2Cl
A.①②④⑤⑥B.②③④⑤⑥C.④⑤⑥⑦⑧D.①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年11月《Nature Energy》報道了巾科院大連化學物理研究所科學家用Ni- BaH2 /Al2O3、Ni- LiH等作催化劑,實現了在常壓、100-300℃的條件下合成氨。
(1)在元素周期表中,氧和與其相鄰且同周期的兩種元素的第一電離能由大到小的順序為 __ ;基態Ni2+的核外電子排布式為 ___,若該離子核外電子空間運動狀態有15種,則該離子處于 ___(填“基”或“激發”)態。
(2)氨在糧食生產、國防中有著無可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是組成最簡單的氨基酸,熔點為182℃,沸點為233℃。
①硝酸溶液中NO3的空間構型為____。
②甘氨酸中N原子的雜化類型為____,分子中σ鍵與π鍵的個數比為____,晶體類型是 ___,其熔點、沸點遠高于相對分子質量幾乎相等的丙酸(熔點為-2l℃,沸點為141℃)的主要原因:一是甘氨酸能形成內鹽;二是____。
(3)NH3分子中的鍵角為107°,但在[Cu(NH3)4]2+離子中NH3分子的鍵角如圖l所示,導致這種變化的原因是____
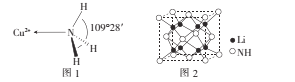
(4)亞氨基鋰(Li2NH)是一種儲氫容量高、安全性能好的固體儲氫材料,其晶胞結構如圖2所示,若晶胞參數為d pm,密度為ρg/cm3,則阿伏加德羅常數NA=____(列出表達式)mol-l。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均為烴的衍生物,它們之間的轉化關系如圖所示,A俗稱酒精;C的分子式為C2H4O2。完成下列填空:
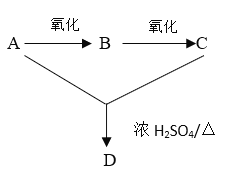
(1)寫出由A轉化為B的化學方程式_______________。檢驗B的試劑為 ________________。
(2)C中的官能團是_______________。
(3)D的結構簡式為_______________;D與CH3CH2CH2COOH互為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化氫H2O2,(氧的化合價為-1價),俗名雙氧水,醫療上利用它有殺菌消毒作用來清洗傷口。對于下列A~D涉及H2O2的反應,填寫空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2僅體現氧化性的反應是(填代號) 。
(2)H2O2既體現氧化性又體現還原性的反應是(填代號) 。
(3)在稀硫酸中,KMnO4和H2O2能發生氧化還原反應。
氧化反應:H2O2-2e-===2H++O2↑
還原反應:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
寫出該氧化還原反應的化學方程式:_______________________。
(4)請配平以下化學方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由下列實驗及現象,推出的相應結論正確的是
實驗 | 現象 | 結論 |
A.用鉑絲蘸取某金屬的鹽溶液, 在酒精燈火焰上灼燒 | 火焰呈黃色 | 此鹽溶液中含有 Na+,不含 K+ |
B.向飽和NaHCO3溶液中加入足量氯水 | 有無色氣體產生 | 氯水中含HClO |
C.將足量SO2氣體通入石蕊試液中 | 石蕊試液變紅色 | SO2水溶液顯酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com