
將煤轉(zhuǎn)化為水煤氣是通過化學(xué)方法將煤轉(zhuǎn)化為潔凈燃料的方法之一。煤轉(zhuǎn)化為水煤氣的主要化學(xué)反應(yīng)為:C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
而C(g)、CO(g)和H2(g)完全燃燒的熱化學(xué)方程式分別為:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
③CO(g)+ O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
請(qǐng)你根據(jù)上述信息回答下列問題:
(1)煤是一種成分復(fù)雜的混合物,其中除含碳、氫元素外,還含有氧、硫、氮、砷、硒等元素。所以固體煤燃燒會(huì)導(dǎo)致大氣污染,寫出煤燃燒產(chǎn)生的兩種污染: ,將石灰石粉與煤粉混合,可以有效地減少煤燃燒過程中的二氧化硫污染,寫出該反應(yīng)的化學(xué)方程式:____________________
(2)根據(jù)已知熱化學(xué)方程式寫出由煤制備水煤氣的熱化學(xué)方程式:____________________________。
(3)下面是甲、乙兩位同學(xué)對(duì)上述熱化學(xué)方程式及煤燃燒的理解。
甲同學(xué):1 mol CO與1 mol H2燃燒放出的熱量之和大于1 mol固體炭燃燒放出的熱量,所以煤燃燒時(shí)加入少量水,可以使煤燃燒放出更多的熱量。
乙同學(xué):根據(jù)下面的物質(zhì)與能量循環(huán),將煤炭轉(zhuǎn)化為水煤氣,再燃燒放出的熱量與直接燃燒煤炭放出的熱量相同,而將煤炭轉(zhuǎn)化為水煤氣將會(huì)增加消耗,故煤炭轉(zhuǎn)化為水煤氣得不償失。
C(s)+H2O(g)+O2(g) CO2(g)+H2O(g)
CO2(g)+H2O(g)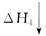

CO(g)+O2(g)+H2(g)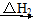 CO(g)+H2O(g)+
CO(g)+H2O(g)+ O2(g)
O2(g)
請(qǐng)你評(píng)價(jià)兩位同學(xué)的理解:
①甲同學(xué)的說法 (答“正確”或“不正確”),原因是______________________________________。
②乙同學(xué)的說法 (答“正確”或“不正確”),原因是_____________________________________。
 高中必刷題系列答案
高中必刷題系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:填空題
根據(jù)下列條件計(jì)算有關(guān)反應(yīng)的焓變:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)==="2NaCl(s)" ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
則反應(yīng)TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反應(yīng)數(shù)值:
| 序號(hào) | 化學(xué)反應(yīng) | 反應(yīng)熱 |
| ① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
| ③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
2013年初,全國各地多個(gè)城市都遭遇“十面霾伏”,造成“陰霾天”的主要根源之一是汽車尾氣和燃煤尾氣排放出來的固體小顆粒。
汽車尾氣凈化的主要原理為:2NO(g)+2CO(g)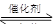 2CO2+N2。在密閉容器中發(fā)生該反應(yīng)時(shí),c(CO2)隨溫度(T)、催化劑的表面積(S)和時(shí)間(t)的變化曲線如下圖所示。據(jù)此判斷:
2CO2+N2。在密閉容器中發(fā)生該反應(yīng)時(shí),c(CO2)隨溫度(T)、催化劑的表面積(S)和時(shí)間(t)的變化曲線如下圖所示。據(jù)此判斷: 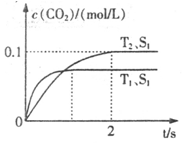
(1)該反應(yīng)為 反應(yīng)(填“放熱”或“吸熱”):在T2溫度下,0~2s內(nèi)的平均反應(yīng)速率:v(N2)= ;(2)當(dāng)固體催化劑的質(zhì)量一定時(shí),增大其表面積可提高化學(xué)反應(yīng)速率。若催化劑的表面積S1>S2,在答題卡上畫出 c(CO2)在T1、S2條件下達(dá)到平衡過程中的變化曲線。
(3)某科研機(jī)構(gòu),在t1℃下,體積恒定的密閉容器中,用氣體傳感器測(cè)得了不同時(shí)間的NO和CO的濃度(具體數(shù)據(jù)見下表,CO2和N2的起始濃度為0)。
| 時(shí)間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
 N2O4 (g) △H=-56.9kJ ? mol-1
N2O4 (g) △H=-56.9kJ ? mol-1查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
磷在自然界常以難溶于水的磷酸鹽如Ca3(PO4)2等形式存在。它的單質(zhì)和化合物有著廣泛的應(yīng)用。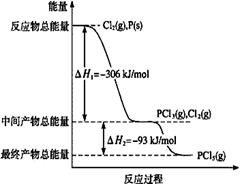
(1)紅磷P(s)和Cl2(g)發(fā)生反應(yīng)生成PCl3(g)和PCl5(g)。反應(yīng)過程和能量關(guān)系如圖所示(圖中的△H表示生成1mol產(chǎn)物的數(shù)據(jù))。
請(qǐng)回答問題:
①PCl5分解成PCl3和Cl2的熱化學(xué)方程式是 。
②P和Cl2分兩步反應(yīng)生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反應(yīng)是可逆反應(yīng)。T℃時(shí),向2.0 L恒容密閉容器中充入1.0 mol PCl5,經(jīng)過250 s達(dá)到平衡。反應(yīng)過程中測(cè)定的部分?jǐn)?shù)據(jù)見下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
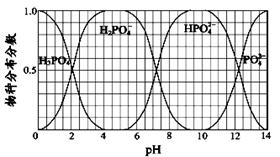
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
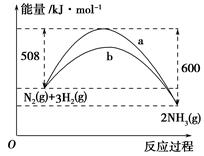
已知各破壞1 mol N≡N鍵、H—H鍵和N—H鍵分別需要吸收的能量為946 kJ、436 kJ、391 kJ。計(jì)算1 mol N2(g)和3 mol H2(g)完全轉(zhuǎn)化為NH3(g)的能量變化理論值為 。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
將煤轉(zhuǎn)化為水煤氣的主要化學(xué)反應(yīng)為C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃燒的熱化學(xué)方程式為:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃燒的熱化學(xué)方程式為:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
請(qǐng)回答:
(1)根據(jù)以上數(shù)據(jù),寫出C(s)與水蒸氣反應(yīng)的熱化學(xué)方程式:________。
(2)比較反應(yīng)熱數(shù)據(jù)可知,1 mol CO(g)和1 mol H2(g)完全燃燒放出的熱量之和比1 mol C(s)完全燃燒放出的熱量多。甲同學(xué)據(jù)此認(rèn)為“煤轉(zhuǎn)化為水煤氣可以使煤燃燒放出更多的熱量”;乙同學(xué)根據(jù)蓋斯定律作出下列循環(huán)圖:
并據(jù)此認(rèn)為“煤轉(zhuǎn)化為水煤氣再燃燒放出的熱量與煤直接燃燒放出的熱量相等”。
請(qǐng)分析:甲、乙兩同學(xué)觀點(diǎn)正確的是________(填“甲”或“乙”);判斷的理由是________。
(3)將煤轉(zhuǎn)化為水煤氣作為燃料和煤直接燃燒相比有很多優(yōu)點(diǎn),請(qǐng)列舉其中的兩個(gè)優(yōu)點(diǎn)________。
(4)水煤氣不僅是優(yōu)良的氣體燃料,也是重要的有機(jī)化工原料。CO和H2在一定條件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。試分析當(dāng)CO和H2按1:1的體積比混合反應(yīng),合成上述________(填序號(hào))物質(zhì)時(shí),可以滿足“綠色化學(xué)”的要求,完全利用原料中的原子,實(shí)現(xiàn)零排放。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(1)①根據(jù)下列圖示,寫出反應(yīng)的熱化學(xué)方程式____________________________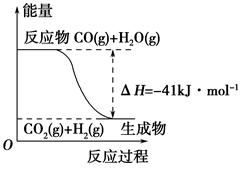
②根據(jù)如圖所示情況,判斷下列說法中正確的是______________。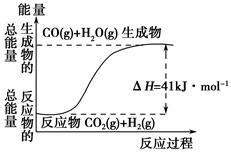
| A.其熱化學(xué)方程式為:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.該反應(yīng)為吸熱反應(yīng) |
| C.該反應(yīng)為放熱反應(yīng) |
| D.當(dāng)H2O為液態(tài)時(shí),其反應(yīng)熱值小于41 kJ·mol-1 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
如圖所示,把試管小心地放入盛有(20 ℃)碳酸飲料的燒杯中,試管中開始放入適量飽和CuSO4溶液,再用滴管滴加5 mL濃硫酸于試管中,試回答下列問題: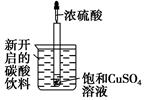
(1)實(shí)驗(yàn)中觀察到的現(xiàn)象是________________。
(2)產(chǎn)生上述現(xiàn)象的原因是________________。
(3)試管中破壞化學(xué)鍵的類型是______________,形成的化學(xué)鍵類型是______________。
(4)寫出有關(guān)現(xiàn)象的化學(xué)方程式______________。
(5)由實(shí)驗(yàn)推知,反應(yīng)所得溶液的總能量__________(填“大于”、“小于”或“等于”)濃硫酸和飽和CuSO4溶液的總能量。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
為了提高資源利用率,減少環(huán)境污染,化工集團(tuán)將鈦廠、氯堿廠和甲醇廠組成產(chǎn)業(yè)鏈,如圖所示。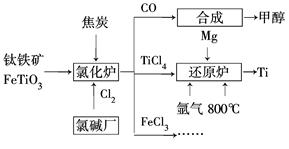
請(qǐng)?zhí)顚懴铝锌瞻住?br />(1)鈦鐵礦進(jìn)入氯化爐前通常采取洗滌、粉碎、烘干、預(yù)熱等物理方法處理,請(qǐng)從原理上解釋粉碎的作用:_______________________________________
已知氯化爐中氯氣和焦炭的理論用料物質(zhì)的量之比為7∶6,則氯化爐中還原劑的化學(xué)式是___________________________。
(2)已知:①M(fèi)g(s)+Cl2(g)=MgCl2(s)ΔH=-641 kJ/mol
②2Mg(s)+TiCl4(s)= 2MgCl(s)+Ti(s)ΔH=-512 kJ/mol
則Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)氬氣通入還原爐中并不參與反應(yīng),通入氬氣的作用是___________________________
(4)以甲醇、空氣、氫氧化鉀溶液為原料,石墨為電極可構(gòu)成燃料電池。已知該燃料電池的總反應(yīng)式為2CH3OH+3O2+4OH-=2CO32—+6H2O,該電池中正極上的電極反應(yīng)式為_________________________________________。
工作一段時(shí)間后,測(cè)得溶液的pH________(填“減小”、“增大”或“不變”)。
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com