
【題目】某航空站安裝了一臺燃料電池,該電池可同時提供電和水蒸氣,所用燃料為氫氣,電解質為熔融的碳酸鉀。已知電池的總反應為2H2+O2=2H2O,正極反應為![]() 。下列說法正確的是
。下列說法正確的是
A.該電池可在常溫或高溫時工作
B.負極反應為![]()
C.該電池工作時負極有CO2生成
D.理論上該電池供應1molH2O,同時導線中轉移2mol電子
科目:高中化學 來源: 題型:
【題目】侯氏制堿法是中國傳統工業方法,此方法制備Na2CO3一直在工業上沿用至今。其原理如下:①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
某化學興趣小組模擬“侯氏制堿法”制純堿并進行后續實驗。
Ⅰ.制備純堿:先以NaCl、NH3、CO2和水等為原料,用如圖所示裝置制取NaHCO3,然后再將NaHCO3制成Na2CO3。

(1)裝置丙中反應的化學方程式為____。
(2)裝置乙的作用是___。為防止污染空氣,尾氣中的___需要進行吸收處理。
(3)用裝置丙中產生的NaHCO3制取Na2CO3時,需要進行的實驗操作有___。
Ⅱ.測定所得產品的組成和純度
(4)檢驗純堿樣品中是否混有NaHCO3,請選擇下列裝置設計實驗,并完成下表:

選擇的裝置(填編號) | 實驗現象 | 實驗結論 |
___ | ___ | 樣品中含NaHCO3 |
(5)測定該純堿樣品的純度:稱取m1g樣品,置于小燒杯中,加水溶解,滴加足量CaCl2溶液。將反應混合物過濾、洗滌、干燥、稱量,得到固體的質量為m2g。則該純堿樣品的純度為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業采用氯化銨焙燒菱錳礦制備高純碳酸錳的流程如圖所示:

已知:①菱錳礦的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分別為4.7、3.2,Mn2+、Mg2+開始沉淀的pH分別為8.1、9.1。
③焙燒過程中主要反應為MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)結合圖1、2、3,分析焙燒過程中最佳的焙燒溫度、焙燒時間、m(NH4Cl)/m(菱錳礦粉)分別為____________、____________、____________。

(2)對浸出液凈化除雜時,需先加入MnO2將Fe2+轉化為Fe3+,再調節溶液pH的范圍__,將Fe3+和Al3+變為沉淀而除去,然后加入NH4F將Ca2+、Mg2+變為氟化物沉淀除去。
(3)“碳化結晶”步驟中,加入碳酸氫銨時反應的離子方程式為____。
(4)上述流程中可循環使用的物質是________。
(5)現用滴定法測定浸出液中Mn2+的含量。實驗步驟:稱取1.000 g試樣,向其中加入稍過量的磷酸和硝酸,加熱使反應2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分進行并除去多余的硝酸;加入稍過量的硫酸銨,發生反應NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亞鐵銨標準溶液進行滴定,發生的反應為[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去過量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分進行并除去多余的硝酸;加入稍過量的硫酸銨,發生反應NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亞鐵銨標準溶液進行滴定,發生的反應為[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去過量的Fe2+。
①酸性K2Cr2O7溶液與Fe2+反應(還原產物是Cr3+)的離子方程式為___________。
②試樣中錳的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有反應:2A(g)+B(g)![]() 3C(g) △H<0,在恒容的密閉容器中,通入A和B氣體,反應達到平衡后,若僅改變圖中x的值,則y隨x變化趨勢合理的是
3C(g) △H<0,在恒容的密閉容器中,通入A和B氣體,反應達到平衡后,若僅改變圖中x的值,則y隨x變化趨勢合理的是
選項 | x | y |
|
A | 溫度 | 容器內混合氣體的密度 | |
B | A的物質的量 | B的轉化率 | |
C | 催化劑的質量 | C的體積分數 | |
D | 充入稀有氣體 | 逆反應速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按第26屆國際計量大會重新定義,阿伏加德羅常數(NA)有了準確值6.02214076×1023。下列說法正確的是
A. 18 gT2O中含有的中子數為12NA
B. 用23.5gAgI與水制成的膠體中膠體粒子數目為0.1NA
C. 標準狀況下,2.24LCl2全部溶于水所得溶液中的Cl-數目為0.1NA
D. 1mol某烷烴CnH2n+2(n≥1)分子中含有的共價鍵數為(3n+1)NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式硫酸鐵[Fe(OH)SO4]是一種用于污水處理的新型高效絮凝劑,在醫藥上也可用于治療消化性潰瘍出血。工業上利用廢鐵屑(含少量氧化鋁、氧化鐵等)生產堿式硫酸鐵的工藝流程如下:
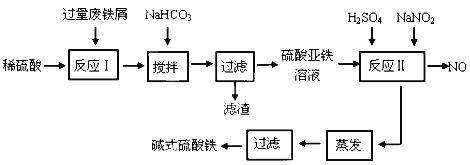
已知:部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
開始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
請回答下列問題:
(1)加入少量NaHCO3的目的是調節pH范圍在__________________________內,使溶液中的___________________沉淀(寫離子符號),該反應的離子方程式為_________________________________ 。
(2)反應Ⅱ中的離子方程式為________________________________________________ 。
(3)在實際生產中,反應Ⅱ常同時通入O2以減少NaNO2的用量,若參與反應的O2有11.2 L(標準狀況),則相當于節約NaNO2的物質的量為_____________________。
(4)堿式硫酸鐵溶于水后產生的Fe(OH)2+離子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合離子,該水解反應的離子方程式為___________________________________。
(5)在醫藥上常用硫酸亞鐵與硫酸、硝酸的混合液反應制備堿式硫酸鐵。根據我國質量標準,產品中不得含有Fe2+及NO3-。為檢驗所得產品中是否含有Fe2+,應使用的試劑為___________________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以柏林綠Fe[Fe(CN)6]為代表的新型可充電鈉離子電池,其放電工作原理如圖所示。下列說法正確的是

A. 放電時,Mo箔上的電勢比Mg箔上的低
B. 充電時,Mo箔接電源的負極
C. 放電時,正極反應為Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充電時,外電路中通過0.2mol電子時,陰極質量增加3.55g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于恒溫、恒容下的反應 2A(g) + 2B(g)3C(g) + D(g),達到平衡狀態的是
A. 單位時間內生成 2n mol A,同時生成 3n mol C
B. 單位時間內生成 n mol B,同時消耗 0.5n mol D
C. 容器內壓強不隨時間而變化
D. 容器內混合氣體的密度不隨時間而變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子中的中心原子雜化軌道的類型相同的是( )
A. CO2與SO2 B. CH4與NH3 C. BeCl2與BF3 D. C2H2與C2H4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com