
【題目】在普通鋁中加入少量Cu和Mg后,形成一種稱為拉維斯相的MgCu2微小晶粒,其分散在Al中可使得鋁材的硬度增加、延展性減小,形成所謂“堅鋁”,是制造飛機的主要村料。回答下列問題:
(1)下列狀態的鎂中,電離最外層一個電子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一種有機化合物,分子中氮、碳的雜化類型分別是_________、_________。乙二胺能與Mg2+、Cu2+等金屬離子形成穩定環狀離子,其中與乙二胺形成的化合物穩定性相對較高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔點如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔點/°C | 1570 | 2800 | 23.8 | 75.5 |
解釋MgO熔點比P4O6熔點高得多的原因______________
(4)金剛石的晶胞如圖,若以硅原子代替金剛石晶體中的碳原子,便得到晶體硅;若將金剛石晶體中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶體(金剛砂)
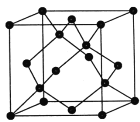
①碳化硅晶體(金剛砂)的化學式______________
②金剛石、晶體硅、碳化硅的熔點由高到低的順序為__________________
③立方氮化硼晶體的結構與金剛石相似,硬度與金剛石相當,晶胞邊長為361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化簡,阿伏加德羅常數為NA)
【答案】A sp3 sp3 Cu2+ MgO為離子晶體,P4O6分子晶體。 SiC C(金剛石)>SiC>Si 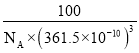
【解析】
(1)能量越高越不穩定,越易失電子,所以激發態的微粒易失電子,原子軌道中處于半滿狀態時較穩定;
(2)每個N原子形成的共價鍵有2個N-H鍵、1個N-C鍵,且還含有1個孤電子對;每個C原子形成的共價鍵有2個C-H鍵、2個C-N鍵,所以N、C原子價層電子對個數都是4,根據價層電子對互斥理論判斷N、C原子雜化類型;含有孤電子對的原子和含有空軌道的原子之間易形成配位鍵;堿土金屬與乙二胺形成的化合物穩定性較弱;
(3)根據晶體類型及構成微粒的作用力大小分析比較;
(4)①根據C、Si原子形成共價鍵數目及空間構型分析化學式;
②根據鍵長越長,鍵能越小,物質的熔沸點就越低比較;
③根據金剛石結構分析一個晶胞中含有的C原子數目,根據二者結構相似,結合氮化硼化學式特點可確定晶胞中含有的B、N原子數目,計算晶胞質量、體積,然后根據晶胞密度ρ=![]() 計算。
計算。
(1)A、D微粒都是Mg原子失去一個電子后得到的,但是D微粒能量高于A,穩定性A>D,所以失電子能力A>D;B、C都是原子,但是B是基態、C是激發態,能量:C>B,穩定性B>C,所以失去一個電子能力:B>C;A為Mg+、B為Mg原子,A再失去電子所需能量就是Mg原子失去2個電子的能量,為Mg原子的第二電離能,B失去一個電子的能量是Mg原子的第一電離能,其第二電離能大于第一電離能,所以電離最外層一個電子所需能量A>B,通過以上分析知,電離最外層一個電子所需能量最大的是A,故合理選項是A;
(2)在乙二胺(H2NCH2CH2NH2)中,每個N原子形成的共價鍵有2個N-H鍵、1個N-C鍵,且還含有1個孤電子對;每個C原子形成的共價鍵有2個C-H鍵、2個C-N鍵,所以N、C原子價層電子對個數都是4,根據價層電子對互斥理論判斷N、C原子雜化類型分別為sp3雜化、sp3雜化;含有孤電子對的原子和含有空軌道的原子之間易形成配位鍵,乙二胺的兩個N提供孤對電子給金屬離子形成配位鍵,所以乙二胺能與Mg2+、Cu2+等金屬離子形成穩定環狀離子;堿土金屬與乙二胺形成的化合物穩定性較弱,所以與乙二胺形成的化合物穩定性相對較高的是Cu2+;
(3) Li2O屬于離子晶體,離子之間以離子鍵結合,離子鍵是一種強烈的相互作用,斷裂消耗較高的能量,因此物質的熔點較高;而P4O6屬于分子晶體,分子之間以微弱的分子間作用力結合,斷裂消耗較低能量,因此P4O6晶體熔沸點比較低;
(4)①在金剛砂中,每個C原子與相鄰的4個Si形成共價鍵,每個Si原子與相鄰的4個C原子形成共價鍵,這種結構向空間擴展,就形成了立體網狀結構,因此金剛砂很硬,二者原子個數比是1:1,所以其化學式是SiC;
②由于金剛石、晶體硅、碳化硅都是原子晶體,原子之間以共價鍵結合,由于原子半徑C<Si,所以鍵長:C-C<C-Si<Si-Si,鍵長越短,原子之間結合力就越強,鍵能就越大,斷裂共價鍵使物質熔化消耗的能量就越高,所以三種物質的熔點由高到低的順序為:金剛石>碳化硅>晶體硅;
③在金剛石晶胞中C原子處在立方體的8個頂點,6個面心,體內有4個,金剛石晶胞中碳原子數目為:4+8×![]() +6×
+6×![]() =8,立方氮化硼結構與金剛石相似,其晶胞與金剛石晶胞含有相同原子總數,由氮化硼化學式BN可推知,一個晶胞中各含有4個B原子、4個N原子,晶胞質量m=4×
=8,立方氮化硼結構與金剛石相似,其晶胞與金剛石晶胞含有相同原子總數,由氮化硼化學式BN可推知,一個晶胞中各含有4個B原子、4個N原子,晶胞質量m=4×![]() g,晶胞的體積V=(361.5×10-10)3cm3,故立方氮化硼的密度ρ=
g,晶胞的體積V=(361.5×10-10)3cm3,故立方氮化硼的密度ρ=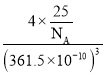 g/cm3=
g/cm3=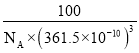 g/cm3。
g/cm3。


科目:高中化學 來源: 題型:
【題目】分析下圖所示的四個原電池裝置,其中結論正確的是( )
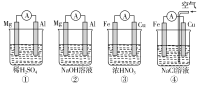
A.①②中Mg作負極,③④中Fe作負極
B.②中Mg作正極,電極反應式為6H2O+6e-=6OH-+3H2↑
C.③中Fe作負極,電極反應式為Fe-2e-=Fe2+
D.④中Cu作正極,電極反應式為2H++2e-=H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向2L恒容密閉容器中充入1molA和1molB,發生反應A(g)+B(g) ![]() C(g),經過一段時間后達到平衡。反應過程中測定的部分數據見下表,下列說法正確的是( )
C(g),經過一段時間后達到平衡。反應過程中測定的部分數據見下表,下列說法正確的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反應在前5s的平均速率V(A)=0.03mol/(L·s)
B.保持其他條件不變,升高溫度,平衡時c(A)=0.41mol·L-1,則反應的△H>0
C.相同溫度下,起始時向容器中充入2.0molC,達到平衡時,C的分解率大于80%
D.相同溫度下,起始時向容器中充入0.2molA.0.2molB和1.0molC,反應達到平衡前反應速率V(正)<V(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。達平衡后,要使HClO濃度增大,可加入( )
H++ClO-。達平衡后,要使HClO濃度增大,可加入( )
A.H2SB.NaHCO3C.鹽酸D.NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.含0.2 mol H2SO4的濃硫酸和足量的銅反應,轉移電子數為0.2NA
B.25 ℃時,1 L pH=13的Ba(OH)2溶液中由水電離產生的OH-的數目為0.1NA
C.15 g HCHO中含有1.5NA對共用電子對
D.常溫常壓下,22.4 L甲烷氣體中含有的氫原子數目小于4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制一定物質的量濃度的KOH溶液時,導致濃度偏低的原因可能是( )
A. 用敞口容器稱量KOH且時間過長
B. 配置前先向容量瓶中加入少量蒸餾水
C. 容量瓶盛過KOH溶液,使用前未洗滌
D. 溶解后快速轉移到容量瓶,然后加足量蒸餾水,定容
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的化合物在生產、生活中廣泛存在
(1)鍵能是氣態原子形成1mol化學鍵釋放的最低能量。已知下列化學鍵的鍵能如表所示,寫出1mol氣態肼(NH2-NH2)燃燒生成氮氣和水蒸氣的熱化學方程式_________
化學鍵 | N≡N | O=O | N-N | N-H | O-H |
鍵能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭還原NO的反應為:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容積均為1L的甲、乙、丙三個恒容恒溫(反應溫度分別為400℃、400℃、T℃)容器中分別加入足量的焦炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如下表所示:
N2(g)+CO2(g),向容積均為1L的甲、乙、丙三個恒容恒溫(反應溫度分別為400℃、400℃、T℃)容器中分別加入足量的焦炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
該反應為_____________(填“放熱”或“吸熱”)反應乙容器中的反應在60min時達到平衡狀態,則0-60min內用NO的濃度變化表示的平均反應速率V(NO)=_________
(3)用焦炭還原NO2的反應為:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒溫條件下,1molNO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
N2(g)+2CO2(g),在恒溫條件下,1molNO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
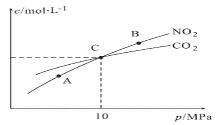
①A、B兩點的濃度平衡常數關系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三點中NO2的轉化率最高的是_____________(填“A”或“B”或“C”)點。
③計算C點時該反應的壓強平衡常數Kp(C)=____________(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各關系式中能說明反應N2+3H2![]() 2NH3已達到平衡狀態的是( )
2NH3已達到平衡狀態的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com