
【題目】草酸(H2C2O4)是一種重要的二元弱酸,還是一種重要的還原劑。草酸及草酸鹽在工農業生產及科學研究領域均有廣泛應用。利用草酸及草酸鹽的性質可測定人體血液中鈣離子的濃度。方法如下:抽取一定體積的血樣,加適量的草酸銨[(NH4)2C2O4]溶液,可析出草酸鈣沉淀,將此草酸鈣沉淀洗滌后溶于強酸可得草酸,再用已知濃度的酸性KMnO4溶液滴定,使草酸轉化成CO2逸出,根據消耗的KMnO4溶液的體積即可測定血液樣品中Ca2+的濃度。
(1)寫出草酸與酸性KMnO4溶液反應的離子方程式______________________________________ 。
(2)抽取血樣10.00mL,經過上述處理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,確定反應達到終點的現象是_______________________________________________________。
(3)滴定結束共消耗12.00mL KMnO4溶液。則血液樣品中Ca2+離子的濃度為______mg/mL。
(4)下列操作可能使所測定結果偏高的是_________。
A.酸式滴定管未用標準液潤洗就直接注入酸性高錳酸鉀溶液
B.滴定前盛放待測液的錐形瓶用蒸餾水洗凈后未干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.滴定結束后讀取標準液體積時,俯視讀數
【答案】2MnO4- + 6H+ + 5H2C2O4 = 2Mn2+ + 8H2O + 10CO2 滴入最后一滴溶液,溶液由無色變為紫紅色,且半分鐘內不變為原來顏色 1.2 AC
【解析】
⑴草酸與酸性KMnO4溶液反應生成錳離子、二氧化碳和水,其離子方程式2MnO4- + 6H+ + 6H2C2O4 = 2Mn2+ + 8H2O + 10CO2。
⑵抽取血樣10.00mL,經過上述處理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,確定反應達到終點的現象是滴入最后一滴溶液,溶液由無色變為紫紅色,且半分鐘內不變為原來顏色。
⑶
5Ca2+—— 5H2C2O4——2MnO4-
5mol 2mol
xmol 0.010mol/L×0.012L
![]()
解得x = 3×10-4mol
10mL血液中含有Ca2+離子的質量為3×10-4mol ×40g/mol = 1.2×10-2g,則血液樣品中Ca2+離子的濃度為1.2×10-2×103 mg/10mL = 1.2mg/mL。
⑷A選項,酸式滴定管未用標準液潤洗就直接注入酸性高錳酸鉀溶液,濃度減小,所需要的體積增多,計算濃度偏高;B選項,滴定前盛放待測液的錐形瓶用蒸餾水洗凈后未干燥,無影響;C選項,酸式滴定管在滴定前有氣泡,滴定后氣泡消失,所測得體積偏大,計算出濃度偏高;D選項,滴定結束后讀取標準液體積時,俯視讀數,讀數偏小,計算結果偏高。
⑴草酸與酸性KMnO4溶液反應生成錳離子、二氧化碳和水,其離子方程式2MnO4- + 6H+ + 6H2C2O4 = 2Mn2+ + 8H2O + 10CO2,故答案為: 2MnO4- + 6H+ + 5H2C2O4 = 2Mn2+ + 8H2O + 10CO2。
⑵抽取血樣10.00mL,經過上述處理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,確定反應達到終點的現象是滴入最后一滴溶液,溶液由無色變為紫紅色,且半分鐘內不變為原來顏色,故答案為:滴入最后一滴溶液,溶液由無色變為紫紅色,且半分鐘內不變為原來顏色。
⑶
5Ca2+—— 5H2C2O4——2MnO4-
5mol 2mol
xmol 0.010mol/L×0.012L
![]()
解得x = 6×10-4mol
10mL血液中含有Ca2+離子的質量為6×10-4mol ×40g/mol = 2.4×10-2g,則血液樣品中Ca2+離子的濃度為2.4×10-2×103 mg/10mL = 2.4mg/mL,故答案為:2.4。
⑷A選項,酸式滴定管未用標準液潤洗就直接注入酸性高錳酸鉀溶液,濃度減小,所需要的體積增多,計算濃度偏高;B選項,滴定前盛放待測液的錐形瓶用蒸餾水洗凈后未干燥,無影響;C選項,酸式滴定管在滴定前有氣泡,滴定后氣泡消失,所測得體積偏大,計算出濃度偏高;D選項,滴定結束后讀取標準液體積時,俯視讀數,讀數偏小,計算結果偏高,故答案為:AC。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】通常人們把拆開1 mol某化學鍵所消耗的能量看成該化學鍵的鍵能。鍵能的大小可以衡量化學鍵的強弱,也可用于估算化學反應的反應熱。
化學鍵 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
鍵能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工業上高純硅可通過下列反應制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),該反應的反應熱△H為
Si(s)+4HCl(g),該反應的反應熱△H為
A. +236 kJ·mol-1B. -236 kJ·mol-1
C. +412 kJ·mol-1D. -412 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以鉻鐵礦![]() 主要成分為
主要成分為![]() ,含有
,含有![]() 、
、![]() 等雜質
等雜質![]() 為原料生產重鉻酸鈉
為原料生產重鉻酸鈉![]() ,其流程如圖1:
,其流程如圖1:
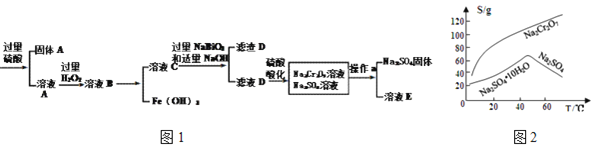
查閱資料得知:
①常溫下,![]() 難溶于水,有強氧化性。
難溶于水,有強氧化性。
②常溫下,![]()
③物質溶解度曲線如圖2所示。
回答下列問題:
(1)![]() 鉻的價態是______,
鉻的價態是______,![]() 的電子式為______。
的電子式為______。
(2)![]() 的作用______。
的作用______。
(3)濾渣D的成分是______。
(4)操作a的名稱是______、______。
(5)電鍍廠產生的鍍銅廢水中往往含有一定量的![]() 處理該廢水的流程為:含
處理該廢水的流程為:含![]() 的廢水
的廢水![]() 含
含![]() 的廢水
的廢水![]() Cr(OH)3沉淀
Cr(OH)3沉淀
①流程中,![]() 參與反應的離子方程式______。
參與反應的離子方程式______。
②![]() ______,
______,![]() 已沉淀完全
已沉淀完全![]() 此時
此時![]() ;若
;若![]() 時,
時,![]() 開始溶解,溶解時的離子方程式為______。
開始溶解,溶解時的離子方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向4.0 L恒容密閉容器中充入2.0 mol PCl5,反應PCl5(g) ![]() PCl3(g)+Cl2(g)經一段時間后達到平衡。反應過程中測定的部分數據見下表:
PCl3(g)+Cl2(g)經一段時間后達到平衡。反應過程中測定的部分數據見下表:
時間/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列說法正確的是( )
A.反應在前50 s的平均反應速率為v(PCl3)=0.006 4 mol/(L·s)
B.相同溫度下,起始時向該容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,達到平衡前v(正)>v(逆)
C.相同溫度下,起始時向該容器中充入4.0 mol PCl3、4.0 mol Cl2,達到平衡時,PCl3的轉化率小于80%
D.保持其他條件不變,升高溫度,平衡時,c(PCl3)=0.11 mol/L,則反應的ΔH<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;請回答下列問題:
(1)NH4Al(SO4)2可作凈水劑,其原理是_____________________________________。(請用離子方程式加文字進行描述)
(2)相同條件下,0.1molL﹣1NH4Al(SO4)2中c(NH4+)________________(填“等于”、“大于”或“小于”)0.1molL﹣1 NH4HCO3中c(NH4+)。
(3)如圖1是0.1molL﹣1電解質溶液的pH隨溫度變化的圖象
①其中符合0.1molL﹣1NH4Al(SO4)2的pH隨溫度變化的曲線是__________(填寫序號)。
②25℃時,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=__________________ molL﹣1(寫出精確結果)。
(4)室溫時,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH與NaOH溶液體積的關系曲線如圖2所示:試分析圖2中a、b、c、d四個點,水的電離程度最大是__________點;在b點,溶液中各離子濃度由大到小的排列順序是______________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置有洗氣、儲氣等用途。在醫院給病人輸氧氣時,也利用了類似的裝置,并在裝置中盛放大約半瓶蒸餾水。對該裝置的說法正確的是
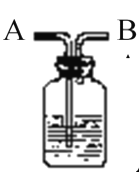
A.導管B連接供給氧氣的鋼瓶
B.導管B連接病人吸氧氣的塑膠管
C.可用來觀察輸出氧氣的速度
D.可用來調節輸出氧氣的速度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸的下列性質中,可以證明它是弱電解質的是( )
![]() 大小相同的鐵片與pH相同鹽酸和醋酸反應,剛開始時醋酸和鹽酸產生H2速率相同;②室溫時,0.1mol/L醋酸溶液的pH約為3;③10mL1mol/L醋酸恰好與10mL1mol/LNaOH溶液完全反應;④常溫下,測得醋酸鈉溶液的pH>7;
大小相同的鐵片與pH相同鹽酸和醋酸反應,剛開始時醋酸和鹽酸產生H2速率相同;②室溫時,0.1mol/L醋酸溶液的pH約為3;③10mL1mol/L醋酸恰好與10mL1mol/LNaOH溶液完全反應;④常溫下,測得醋酸鈉溶液的pH>7;![]() 醋酸溶液的導電性比鹽酸溶液的弱;⑥常溫下,將pH=1的醋酸和鹽酸稀釋相同的倍數倍,測得醋酸的pH變化較小。
醋酸溶液的導電性比鹽酸溶液的弱;⑥常溫下,將pH=1的醋酸和鹽酸稀釋相同的倍數倍,測得醋酸的pH變化較小。
A.②④⑤⑥B.②④⑥C.①②④D.②⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于古籍中的記載說法不正確的是
A. 《本草綱目》“燒酒”條目下寫道自元時始創其法,用濃酒和糟入甑,蒸令氣上其清如水,味極濃烈,蓋酒露也”。這里所用的“法”是指蒸餾
B. 《呂氏春秋·別類編》中“金(即銅)柔錫柔,合兩柔則剛” 體現了合金硬度方面的特性
C. 《本草經集注》中關于鑒別硝石(KNO3)和樸硝(Na2SO4)的記載:“以火燒之,紫青煙起,乃真硝石也”,該方法應用了顯色反應
D. 《抱樸子·金丹篇》中記載:“丹砂(HgS)燒之成水銀,積變又成丹砂”,該過程發生了分解、化合、氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某燒堿溶液中含有少量雜質(不與鹽酸反應),現用中和滴定測定其濃度。
(1)用_______式滴定管盛裝c mol/L鹽酸標準液。配制c mol/L鹽酸標準液,必須使用的主要容器是____________ 如圖表示某次滴定時50 mL滴定管中前后液面的位置。滴定管讀數時應注意____________________________________。尖嘴部分應____________________________。用去的標準鹽酸的體積是_____________mL

(2)該實驗應選用_____作指示劑;操作中如何確定終點?______________________________。
(3)對下列兩種假定情況進行討論:(填“無影響”、“偏高”、“偏低”)
a.若滴定前用蒸餾水沖洗錐形瓶,則會使測定結果__________;
b.若在滴定過程中不慎將數滴酸液滴在錐形瓶外,則會使測定結果__________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com