
| A.根據Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大 |
| B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氫氣體,最終得不到ZnS沉淀。是因為溶液中c(Zn2+)·c(S2-)>Ksp(ZnS) |
| C.向硫酸鋇沉淀中加入碳酸鈉溶液,沉淀發生轉化,據此可推知碳酸鋇的Ksp比硫酸鋇的小 |
| D.AgCl在10mL 0.05mol·L-1的KCl溶液中比在20mL0.01mol·L-1的AgNO3溶液中溶解的質量少 |
科目:高中化學 來源:不詳 題型:單選題
| A.AgI比AgCl穩定 | B.氯的非金屬性比碘強 |
| C.I-的還原性比Cl-強 | D.AgI的溶解度比AgCl小 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
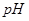 的變化如下圖所示。下列判斷正確的是( )
的變化如下圖所示。下列判斷正確的是( ) 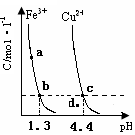
A.加適量濃NH3·H2O可使溶液由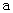 點變到 點變到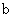 點 點 |
B.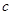  兩點代表的溶液中 兩點代表的溶液中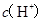 與 與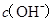 乘積不相等 乘積不相等 |
C.Cu(OH)2在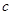 點比在d點代表的溶液中溶解程度小 點比在d點代表的溶液中溶解程度小 |
D.該溫度下,氫氧化鐵的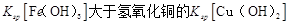 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.AgCl飽和溶液中c(Ag+)比AgI飽和溶液中c(Ag+)大 |
| B.AgCl飽和溶液中c(Ag+)比Mg(OH)2飽和溶液中c(Mg2+)大 |
| C.將AgCl與AgI的飽和溶液等體積混合,再加入足量濃AgNO3溶液,則發生的反應為:AgCl與AgI沉淀都有,但以AgI沉淀為主。 |
| D.若往AgCl飽和溶液中加入0.1 mol/LKI溶液,有黃色沉淀產生 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
| 實驗步驟 | 向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反應完全。 |
| 實驗現象 | 產生白色沉淀 |
| 離子方程式 | (1) |
| 小組討論交流 | 向上述反應后的清液中滴入適量1mol/L的Na2CO3溶液會出現什么現象 |
| 假設出現的實驗現象,說明理由 | 假設Ⅰ: 無現象; 理由:反應沒有限度,Ca2+沉淀完全 假設Ⅱ:(2) ,理由:(3) |
| 證明你的假設 | 現象:產生大量的白色沉淀 |
| 離子方程式 | (4) |
| 實驗結論 | (5) |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.用稀鹽酸洗滌AgCl沉淀比用水洗滌損耗AgCl小; |
| B.沉淀反應中常加過量的沉淀劑,其目的是使沉淀完全 |
C.對于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者為溶解平衡,后者為電離平衡; Al3++3OH-,前者為溶解平衡,后者為電離平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,說明Mg(OH)2的溶解度比MgCO3大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
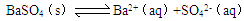 的下列說法正確的是( )
的下列說法正確的是( )| A.溶液的溫度升高,BaSO4的溶度積常數不變 |
| B.在Na2SO4溶液中,BaSO4的溶解度不變 |
| C.在BaCl2溶液中,BaSO4的溶度積常數變小 |
| D.精制NaCl時,在溶液中加入稍過量的BaCl2溶液是為了更好地除去SO42-等離子 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.25 ℃時,飽和Mg(OH)2溶液與飽和MgF2溶液相比,前者的C(Mg2+)大 |
| B.25 ℃時,在Mg(OH)2的懸濁液中加入少量的NH4Cl固體,C(Mg2+)增大 |
| C.25 ℃時,Mg(OH)2固體在20 mL 0.01 molL-1氨水中的Ksp比在20 mL 0.01molL-1NH4Cl溶液中的Ksp小 |
| D.25 ℃時,在Mg(OH)2懸濁液中加入NaF溶液后,Mg(OH)2不可能轉化為MgF2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
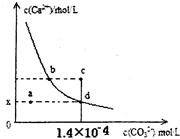
| A.x的數值為2×10-5 |
| B.c點時有CaCO3生成 |
| C.加入蒸餾水可使溶液由d點變成 a點 |
| D.b點與d點對應的溶度積相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com