
【題目】研究+6價鉻鹽不同條件下微粒存在形式及氧化性,某小組同學進行如下實驗:
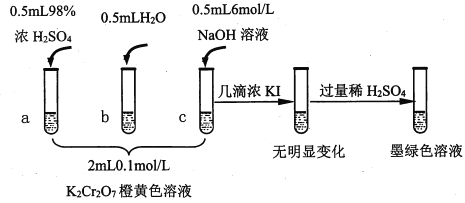
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黃色)+2H+ △H= +13.8 kJ/mol,+6價鉻鹽在一定條件下可被還原為Cr3+,Cr3+在水溶液中為綠色。
2CrO42-(黃色)+2H+ △H= +13.8 kJ/mol,+6價鉻鹽在一定條件下可被還原為Cr3+,Cr3+在水溶液中為綠色。
(1)試管c和b對比,推測試管c的現象是________。
(2)試管a和b對比,a中溶液橙色加深。甲認為溫度也會影響平衡的移動,橙色加深不一定是c(H+)增大影響的結果;乙認為橙色加深一定是c(H+)增大對平衡的影響。你認為是否需要再設計實驗證明?____(“是”或“否”),理由是_________________________________。
(3)對比試管a、b、c的實驗現象,得到的結論是________________。
(4)試管c繼續滴加KI溶液、過量稀H2SO4,分析上圖的實驗現象,得出的結論是_______;寫出此過程中氧化還原反應的離子方程式________________。
(5)小組同學用電解法處理含Cr2O72-廢水,探究不同因素對含Cr2O72-廢水處理的影響,結果如下表所示(Cr2O72-的起始濃度,體積、電壓、電解時間均相同)。
實驗 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
電極材料 | 陰、陽極均為石墨 | 陰、陽極均為石墨 | 陰、陽極均為石墨 | 陰極為石墨,陽極為鐵 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①實驗ⅱ中Cr2O72-放電的電極反應式是________________。
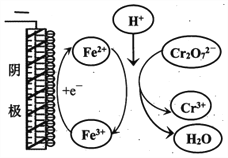
②實驗ⅲ中Fe3+去除Cr2O72-的機理如圖所示,結合此機理,解釋實驗iv中Cr2O72-去除率提高較多的原因_______________。
【答案】 溶液變黃色 否 Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果 堿性條件下,+6價鉻主要以CrO42-存在;酸性條件下,主要以Cr2O72-存在 堿性條件下,CrO42-不能氧化I-;酸性條件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性強于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 陽極Fe失電子生成Fe2+,Fe2+與Cr2O72-在酸性條件下反應生成Fe3+,Fe3+在陰極得電子生成Fe2+,繼續還原Cr2O72-,Fe2+循環利用提高了Cr2O72-的去除率
2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果 堿性條件下,+6價鉻主要以CrO42-存在;酸性條件下,主要以Cr2O72-存在 堿性條件下,CrO42-不能氧化I-;酸性條件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性強于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 陽極Fe失電子生成Fe2+,Fe2+與Cr2O72-在酸性條件下反應生成Fe3+,Fe3+在陰極得電子生成Fe2+,繼續還原Cr2O72-,Fe2+循環利用提高了Cr2O72-的去除率
【解析】(1)針對Cr2O72- (橙色)+H2O![]() 2CrO42-(黃色)+2H+反應來說,試管c中加入堿,消耗了H+,平衡右移,溶液變黃色;正確答案:溶液變黃色。
2CrO42-(黃色)+2H+反應來說,試管c中加入堿,消耗了H+,平衡右移,溶液變黃色;正確答案:溶液變黃色。
(2)Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果;正確答案:否;Cr2O72-(橙色)+H2O
2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果;正確答案:否;Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果。
2CrO42-(黃色)+ 2H+正向是吸熱反應,若因濃H2SO4溶于水而溫度升高,平衡正向移動,溶液變為黃色。而實際的實驗現象是溶液橙色加深,說明橙色加深就是增大c(H+)平衡逆向移動的結果。
(3)對比試管a、b、c的實驗現象,得到的結論在酸堿性不同的情況下,溶液中主要存在的離子不同;堿性條件下,+6價鉻主要以CrO42-存在;酸性條件下,主要以Cr2O72-存在;正確答案:堿性條件下,+6價鉻主要以CrO42-存在;酸性條件下,主要以Cr2O72-存在。
(4)從實驗現象分析可知:堿性條件下,CrO42-不能氧化I-,所以無明顯變化;酸性條件下,Cr2O72-能氧化I-,本身被還原為Cr3+,變為墨綠色溶液;此過程中氧化還原反應的離子方程式:. 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O ;正確答案:堿性條件下,CrO42-不能氧化I-;酸性條件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性強于CrO42-);6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O。
(5)①實驗ⅱ中Cr2O72-在陰極被還原為Cr3+,電極反應式Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O;正確答案:Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O。
②根據圖示分析可知:陽極Fe失電子生成Fe2+,Fe2+與Cr2O72-在酸性條件下反應生成Fe3+,Fe3+在陰極得電子生成Fe2+,繼續還原Cr2O72-,Fe2+循環利用提高了Cr2O72-的去除率;正確答案:陽極Fe失電子生成Fe2+,Fe2+與Cr2O72-在酸性條件下反應生成Fe3+,Fe3+在陰極得電子生成Fe2+,繼續還原Cr2O72-,Fe2+循環利用提高了Cr2O72-的去除率。


科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”,下列做法有利于環境保護和可持續發展的是( )
A.大量生產一次性超薄塑料袋方便日常生活
B.對所有垃圾以直接露天焚燒的方式進行處理
C.加大農藥和化肥的生產和使用量,以提高糧食的產量
D.推行綠色設計、綠色工藝、開發綠色產品,從源頭上消除污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列電離方程式判斷,下列分組正確的是( )
①H2SO4===2H++![]() 、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2
、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2![]() 、④NaHSO4===Na++H++
、④NaHSO4===Na++H++![]()
A. 屬于酸的是①④ B. 屬于堿的是②
C. 屬于鹽的只有③ D. 屬于鹽的只有④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知100 kPa、298.15 K時氫氟酸的電離過程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,試判斷該過程的自發性( )
A. 可自發進行 B. 不能自發進行 C. 達到平衡 D. 不能判定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一個密閉容器,中間有一可自由滑動的隔板(厚度不計)將容器分成兩部分,當左邊充入8molN2,右邊充入CO和CO2的混合氣體共64g時,隔板處于如圖位置(保持溫度不變),下列說法正確的是( )

A. 右邊CO與CO2分子數之比為3:1
B. 右側CO的質量為14g
C. 右側氣體密度是相同條件下氧氣密度的2倍
D. 若改變右邊CO和CO2的充入量而使隔板處于距離右端1/3處,保持溫度不變,則前后兩次充入情況容器內的壓強之比為6: 5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的變化趨勢如圖所示(不考慮NH3的逸出)。下列說法正確的是

A. M點溶液中水的電離程度比原溶液大
B. 在M點時,n(H+)-n(OH-)=(0.005-a)mol
C. 隨著NaOH溶液的滴加,![]() 不斷增大
不斷增大
D. 當n(NaOH)=0.01mol時,c(NH3·H2O)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應不屬于取代反應的是
A. ![]() + HO-NO2
+ HO-NO2 ![]()
![]()
B. ClCH2CH=CH2 + NaOH![]() HOCH2CH=CH2 + NaCl
HOCH2CH=CH2 + NaCl
C. 2 CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. BrCH2CH3 + NaOH![]() CH2 = CH2 ↑+ NaBr +H2O
CH2 = CH2 ↑+ NaBr +H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在盛有稀H2SO4的燒杯中放入用導線連接鋅片和銅片,下列敘述正確的是
A.正極附近的SO42―離子濃度逐漸增大
B.電子通過導線由銅片流向鋅片
C.正極有O2逸出
D.銅片上有H2逸出
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com