
【題目】Ⅰ.某溫度時,在一個10L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示,根據圖中數據填空:

(1)該反應的化學方程式為______________________________;
(2)反應開始至2min,以氣體Z表示的平均反應速率為__________;
(3)平衡時容器內混合氣體密度比起始時________(填“變大”,“變小”或“相等”下同),混合氣體的平均相對分子質量比起始時_________;
(4)將a mol X與b mol Y的混合氣體發生上述反應,反應到某時刻各物質的量恰好滿足:n(X)=n(Y)=2n(Z),則原混合氣體中a:b=___________。
Ⅱ.在恒溫恒容的密閉容器中,當下列物理量不再發生變化時:①混合氣體的壓強,②混合氣體的密度,③混合氣體的總物質的量,④混合氣體的平均相對分子質量,⑤混合氣體的顏色,⑥各反應物或生成物的反應速率之比等于化學計量數之比
(1)一定能證明I2(g)+H2(g)![]() 2HI(g)達到平衡狀態的是_________。
2HI(g)達到平衡狀態的是_________。
(2)一定能證明A(s)+2B(g)![]() C(g)+D(g)達到平衡狀態的是________。
C(g)+D(g)達到平衡狀態的是________。
【答案】3X(g)+ Y(g)![]() 2Z(g) 0.01molL-1min-1 相等 變大 7:5 ⑤ ②④
2Z(g) 0.01molL-1min-1 相等 變大 7:5 ⑤ ②④
【解析】
根據反應物生成物的變化量之比書寫相應的反應方程式;根據速率表達式計算反應速率;根據密度公式及摩爾質量公式比較反應前后密度和摩爾質量的變化;運用三段式法進行相關計算;根據化學平衡狀態的本質和特征分析反應達到平衡的標志。
(1)根據圖示的內容知道,X和Y是反應物,Z為生成物,X、Y、Z的變化量之比是0.3:0.1:0.2=3:1:2,則反應的化學方程式為:3X(g)+ Y(g)![]() 2Z(g);
2Z(g);
(2)反應開始至2min,以氣體Z表示的平均反應速率為:υ(Z)=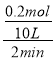 =0.01mol/(L·min);
=0.01mol/(L·min);
(3)混合氣體密度![]() ,從開始到平衡,質量是守恒的,體積是不變的,所以密度始終不變;混合氣體的平均相對分子質量
,從開始到平衡,質量是守恒的,體積是不變的,所以密度始終不變;混合氣體的平均相對分子質量![]() ,從開始到平衡,質量是守恒的,但是n是逐漸減小的,所以M會變大,因此,本題正確答案是:相等;變大;
,從開始到平衡,質量是守恒的,但是n是逐漸減小的,所以M會變大,因此,本題正確答案是:相等;變大;
(4) 3X(g)+ Y(g)![]() 2Z(g) (設Y的變化量是x)
2Z(g) (設Y的變化量是x)
初始量 a b 0
變化量 3x x 2x
某時刻量 a-3x b-x 2x
當n(X)=n(Y)=2n(Z)時, a-3x=b-x=4x,則a=7x,b=5x,所以a:b=7:5;
Ⅱ.(1)①反應前后氣體系數之和相等,因此壓強不變,不能說明反應達到平衡,故①錯誤;②組分都是氣體,氣體質量不變,是恒容狀態,容器的體積不變,因此密度不變,不能說明反應達到平衡,故②錯誤;③反應前后氣體系數之和相等,因此物質的量不變,不能說明反應達到平衡,故③錯誤;④根據M=m/n,組分都是氣體,氣體質量不變,氣體總物質的量不變,因此當M不變,不能說明反應達到平衡,故④錯誤;⑤I2是有顏色的氣體,因此顏色不變,說明反應達到平衡,故⑤正確;⑥沒有指明反應進行方向,故⑥錯誤;
(2)①反應前后氣體系數之和相等,因此壓強不變,不能說明反應達到平衡,故①錯誤;②A為固體,其余為組分都是氣體,氣體質量增加,是恒容狀態,容器的體積不變,因此密度不變,說明反應達到平衡,故②正確;③氣體物質的量不變,因此總物質的量不變,不能說明反應達到平衡,故③錯誤;④根據M=m/n,氣體質量增加,氣體物質的量不變,因此當M不變,說明反應達到平衡,故④正確;⑤題目中沒有說明氣體的顏色,因此顏色不變,不能說明反應達到平衡,故⑤錯誤;⑥沒有指明反應進行方向,故⑥錯誤。
故答案為: (1). ⑤;(2)②④。


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】下列關于化學反應與能量的說法正確的是( )
A.古文說“冰,水為之,而寒于水”說明等量的水和冰相比,冰的能量更高
B.化學反應遵循質量守恒定律的同時,也遵循能量守恒定律
C.已知C(石量,s)=C(金剛石,s) H>0,則金剛石比石墨穩定
D.任何化學反應都伴隨著能量變化,其表現形式只有吸熱和放熱兩種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關同分異構體的敘述正確的是
A. 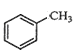 苯環上的一個氫原子被含1個氯原子取代,所得產物有5種
苯環上的一個氫原子被含1個氯原子取代,所得產物有5種
B. 丁烷(C4H10)的二氯取代物只能有4種
C. 菲的結構式為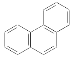 ,其一硝基取代物有10種
,其一硝基取代物有10種
D. 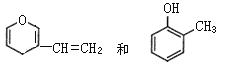 互為同分異構體
互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A.1molCO2 的質量為44g/molB.CO2的摩爾質量為44g
C.CO2的摩爾質量等于CO2的相對分子質量D.NA個CO2的質量(以克為單位)與CO2的相對分子質量在數值上相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某磁黃鐵礦的主要成分是FexS(S為-2價),既含有Fe2+,又含有Fe3+,將一定量的該磁黃鐵礦與100mL的鹽酸恰好完全反應(注:礦石中其他成分不與鹽酸反應),生成2.4g硫單質,0.425mol FeCl2 和一定量H2S氣體,且溶液中無Fe3+。則下列說法正確的是
A. 該鹽酸的物質的量濃度為4.25mol·L-1
B. 該磁黃鐵礦FexS中,Fe2+與Fe3+的物質的量之比為3∶1
C. 成的H2S氣體在標準狀況下的體積為2.24L
D. 該磁黃鐵礦中FexS的x=0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列能說明苯酚是弱酸的實驗事實是
A. 苯酚遇FeCl3溶液呈紫色 B. 苯酚能與NaOH溶液反應
C. 常溫下苯酚在水中的溶解度不大 D. 將CO2通入苯酚鈉溶液出現渾濁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類推思維是化學解題中常用的一種思維方法,下列有關離子方程式的類推正確的是)
選項 | 已知 | 類推 |
A | 將Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 將Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性電極電解氯化鈉溶液:2Cl-+2H2O | 惰性電極電解MgBr2溶液:2Br-+2H2O |
D | 稀鹽酸與NaOH溶液反應至中性:H++OH-===H2O | 稀硝酸與Ba(OH)2溶液反應至中性:H++OH-===H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(一)合成氨工藝(流程如圖所示)是人工固氮最重要的途徑。

2018年是合成氨工業先驅哈伯(PHaber)獲得諾貝爾獎100周年。N2和H2生成NH3的反應為:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化劑作用下的反應歷程為(*表示吸附態)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化劑作用下的反應歷程為(*表示吸附態)
化學吸附:N2(g)→2N*;H2(g)→2H*;
表面反應:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脫附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反應活化能高、速率慢,決定了合成氨的整體反應速率。 請回答:
(1)利于提高合成氨平衡產率的條件有__________。
A.低溫 B.高溫 C.低壓 D.高壓 E.催化劑
(2)標準平衡常數KΘ=![]() ,其中pΘ為標準壓強(1X105Pa),p NH3、 p N2和p H2為各組分的平衡分壓,如p NH3=x NH3 p,p為平衡總壓,x NH3為平衡系統中NH3的物質的量分數。
,其中pΘ為標準壓強(1X105Pa),p NH3、 p N2和p H2為各組分的平衡分壓,如p NH3=x NH3 p,p為平衡總壓,x NH3為平衡系統中NH3的物質的量分數。
①N2和H2起始物質的量之比為1:3,反應在恒定溫度和標準壓強下進行,NH3的平衡產率為w,則KΘ=_____________(用含w的最簡式表示)
②下圖中可以示意標準平衡常數KΘ隨溫度T變化趨勢的是_______。
 (3)實際生產中,常用工藝條件,Fe作催化劑,控制溫度773K,壓強3.0X105Pa,原料中N2和H2物質的量之比為1:2.8。
(3)實際生產中,常用工藝條件,Fe作催化劑,控制溫度773K,壓強3.0X105Pa,原料中N2和H2物質的量之比為1:2.8。
①分析說明原料氣中N2過量的理由________________________。
②關于合成氨工藝的下列理解,正確的是_______。
A.合成氨反應在不同溫度下的△H和△S都小于零
B.控制溫度(773K)遠高于室溫,是為了保證盡可能的平衡轉化率和快的反應速率
C.當溫度、壓強一定時,在原料氣(N2和H2的比例不變)中添加少量惰性氣體,有利于提高平衡轉化率
D.基于NH3有較強的分子間作用力可將其液化,不斷將液氨移去,利于反應正向進行
E.分離空氣可得N2,通過天然氣和水蒸氣轉化可得H2,原料氣須經過凈化處理,以防止催化劑中毒和安全事故發生。
(二)高鐵酸鉀(K2FeO4)可用作水處理劑。某同學通過“化學-電解法”探究的合成,其原理如圖所示。接通電源,調節電壓,將一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制溫度,可制得K2FeO4。

(1)請寫出“化學法”得到FeO42-的離子方程式___________________________。
(2)請寫出陽極的電極反應式(含FeO42-)___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCN是重要的化工原料,可應用于冶金等領域,回答下列問題:
(1)NaCN中C的化合價為_____;寫出NaCN的電子式:_______________;
(2)現代開采金礦的流程如下:
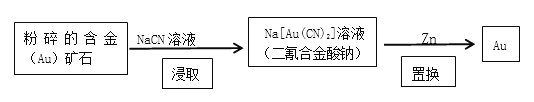
“粉碎”的目的是____________________;“浸取”反應的氧化劑是____________;消耗的鋅與生成的金的物質的量之比為___________。
(3)工業上常用純堿、焦炭、氨氣反應制備NaCN,寫出反應的化學方程式:________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com