
【題目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一種或幾種物質組成。進行如下實驗。下列有關說法正確的是:

A. 根據上述步驟II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步驟I中減少的3 g固體一定是混合物
C. 步驟II中質量減少的物質一定是Cu
D. 根據步驟I、II可以判斷混合物X的成分為Al2O3、Fe2O3、Cu、SiO2
【答案】A
【解析】
9.4gX與過量的氫氧化鈉溶液反應后得到6.4g不溶物,固體部分溶解,原固體中至少含有Al2O3、SiO2的一種物質;6.4g固體與過量的鹽酸反應得到藍色溶液,藍色溶液中存在銅離子,發生了反應:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,說明溶液中一定存在Fe2O3,1.92g固體為銅。
A、設氧化鐵的物質的量是x,金屬銅的物質的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,則160x+64y=6.4,64y-64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化鐵的質量為0.02mol×160g·mol-1=3.2g,金屬銅的質量為0.05mol×64g·mol-1=3.2g,則原混合物中m(Fe2O3):m(Cu)=1:1,故A正確。
B、步驟Ⅰ中,加入過量氫氧化鈉溶液固體質量減少了3 g,溶解的物質可能是Al2O3和SiO2中的一種或兩種,故B錯誤;
C、步驟Ⅱ中加入過量鹽酸,Fe2O3溶解后又和Cu發生反應,故減少的固體是Fe2O3和Cu,故C錯誤;
D、根據步驟I只能判斷混合物中至少含有Al2O3、SiO2的一種物質,無法確定Al2O3、SiO2是否都存在;步驟II可以確定一定存在Fe2O3、Cu,故D錯誤;
故選A。


科目:高中化學 來源: 題型:
【題目】下列變化不可能通過一步反應直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物 X 可能是由 Na2SiO3、 Fe 、 Na2CO3、 BaCl2中的兩種或兩種以上的物質組成。某興趣小組為探究該固體混合物的組成,設計實驗方案如下圖所示(所加試劑均過量)。下列說法不正確的是:

A. 該固體混合物一定含有 Fe、 Na2CO3、 BaCl2
B. 氣體A一定是混合氣體
C. 白色沉淀B在空氣中逐漸變灰綠色,最后變紅褐色
D. 沉淀A一定是 H2SiO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ亞鐵氰化鉀K4[Fe(CN)6],俗名黃血鹽,可溶于水,不溶于乙醇。它是一種食品添加劑,我們所食用的部分食鹽中就添加了亞鐵氰化鉀作為抗結劑。如果食用過量,易引起胃腸適。同學們可以觀察一下家中食鹽的配料表,盡量選用不含抗結劑的食鹽。亞鐵氰化鉀可用如下方法進行制備。
已知HCN是一種極弱的酸,現有一種用含NaCN的廢水合成黃血鹽的主要工藝流程如下:
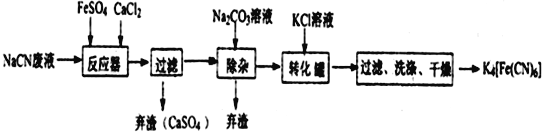
(1)常溫下,NaCN水溶液的pH_______7(填“>”、“<”、“ = ”)。
(2)反應器中發生的主要反應的化學方程式為_____________________________。
(3)流程中加入Na2CO3溶液后過濾除去棄渣,過濾需要的玻璃儀器有燒杯、漏斗、______________。
(4)轉化器中生成K4[Fe(CN)6]的反應類型是_______________,相同溫度下,溶解度:K4[Fe(CN)6]___________Na4[Fe(CN)6](填“>”“ = ”“<”)。
(5)實驗室常用K4[Fe(CN)6]檢驗Fe3+,生成難溶鹽KFe[Fe(CN)6],試寫出上述反應的離子方程式為_____________________________。
Ⅱ亞鐵氰化鉀也可以用硫酸亞鐵銨為原料制備。可以用氧化還原滴定法測定晶體中Fe2+的含量。稱取一份質量為20.0g 的硫酸亞鐵銨晶體樣品,制成溶液。用0.5 mol/L KMnO4溶液滴定,當溶液中Fe2+全部被氧化,MnO4- 被還原成Mn2+時,耗KMnO4 溶液體積20.00mL。
滴定時,將KMnO4 溶液裝在____(酸式或堿式) 滴定管中,判斷反應到達滴定終點的現象為__________ ;晶體中FeSO4的質量分數為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子序數依次遞增的甲、乙、丙、丁、戊是周期表中前30號元素,其中甲、乙、丙三元素的基態原子2p能級都有單電子,單電子個數分別是2、3、2;丁與戊原子序數相差18,戊元素是周期表中ds區的第一種元素。回答下列問題:
(1)甲能形成多種常見單質,在熔點很高的兩種常見單質中,原子的雜化方式分別為______、__________。
(2)+1價氣態基態陽離子再失去一個電子形成+2價氣態基態陽離子所需要的能量稱為第二電離能I2,依次還有I3、I4、I5…,推測丁元素的電離能突增應出現在第________電離能。
(3)戊的基態原子有________種形狀不同的原子軌道;
(4)甲、乙分別都能與丙形成原子個數比為 1:3的微粒,則該兩種微粒的空間構型分別為:_________________ ;__________________。
(5)丙和丁形成的一種離子化合物的晶胞結構如右圖,該晶體中陽離子的配位數為_________ 。距一個陰離子周圍最近的所有陽離子為頂點構成的幾何體為_______________。已知該晶胞的密度為ρ g/cm3,阿伏加德羅常數為NA,該化合物的相對分子質量為 M,則該晶胞中黑球的半徑r =_____cm。(用含ρ、NA的計算式表示)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某銅礦石的主要成分是Cu2O,還含有少量的Al2O3、Fe2O3和SiO2。某工廠利用此礦石煉制精銅的工藝流程如圖所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。
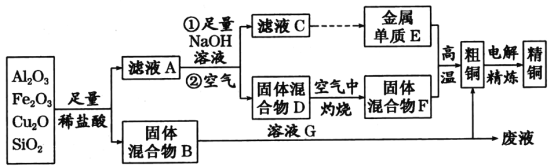
(1)濾液A中鐵元素的存在形式為______________(填離子符號),生成該離子的離子方程式為____________________________________________________________________,
(2)金屬E與固體F發生的某一反應可用于焊接鋼軌,該反應的化學方程式為_____________,
在實驗室中完成此實驗還需要的試劑是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)溶液G與固體混合物B反應的離子方程式為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A. 氫氟酸貯存在細口玻璃瓶里
B. 盛溴的試劑瓶里加一些水來防止溴揮發
C. 可用滴加酚酞看其是否變紅的方法來檢測久置的燒堿是否變質
D. 氯水保存在無色玻璃瓶中;液氯存貯存在鋼瓶里
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關敘述正確的是( )
A. H+(aq)+OH-(aq)===H2O(l) ΔH=-a kJ· mol-1,故1 mol NaOH固體與足量的稀鹽酸反應,放出熱量為a kJ
B. 常溫下,將10 mL pH=a的鹽酸與100 mL pH=b的Ba(OH)2溶液混合后恰好中和,則a+b=13
C. 鍍鋅鋼管破損后,負極反應式為Fe-2e-===Fe2+
D. 把碳酸氫鈉溶液蒸干灼燒,最后得到的固體產物是碳酸氫鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在無色透明的強酸性溶液中,能大量共存的離子組是
A.K+、Na+、NO3-、HCO3-B.K+,Cu2+、Na+、Cl-
C.Na+、Mg2+、NO3-、SO42-D.Ag+、Na+、Cl-、OH-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com