
用化學反應原理相關知識同答
I.根據下表所示化學反應與數據關系回答下列問題: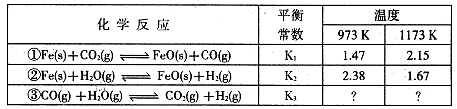
(1)反應①是 (填“吸熱"或“放熱”)反應。
(2)根據反應①與②可推導出同溫下K1、K2與K3之間的關系,則K3= (用K1、K2表示)。
(3)若反應③的逆反應速率與時間的關系如圖所示: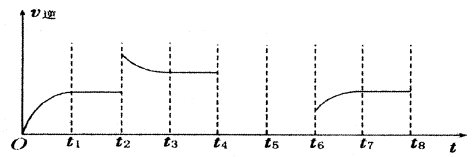
①反應在t1、t3、t7時都達到了平衡,若t2時只改變了一種外界條件j試判斷:改變的條件可能是 。
②若t4時降壓,t6時增大反應物的濃度,請在圖中畫出t4~t6時逆反應速率與時間的關系曲線。
II.請根據醋酸的電離平衡回答下列問題:
(1)常溫下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子發生電離,則溶液的pH= 。
(2)將上述溶液加蒸餾水稀釋,在稀釋過程中,下列各項中增大的是 (填字母編號)。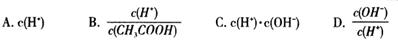
(3)25℃時,CH3COOH的電離平衡常數為1.75×10-5,現將一定量的CH3COOH與NaOH溶液混合,若測得混合液pH=5.6,則混合液中各離子濃度由大到小的順序是 。
Ⅰ
(1)吸熱
K2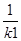
①升高溫度或增大CO2的濃度(增大H2的濃度)
②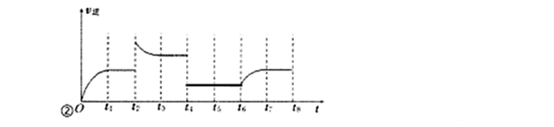
Ⅱ、(1)3
(2)BD
(3) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
解析試題分析:Ⅰ(1)升高溫度,平衡常數增大,正反應是吸熱反應。
K3=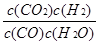 而K1=
而K1=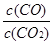 ,K2=
,K2=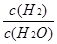 故K3=K2X
故K3=K2X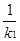
(3)?升高溫度或增大CO2的濃度(增大H2的濃度)
Ⅱ、(1)根據c(H+)=c(HAc)ɑ,則c(H+)=0.1X1%,PH=3
電離常數不變,c(H+)在稀釋過程中總體是減小的;水的離子積常數不變;c(H+)減小,則c(OH-)增大,故選BD。
(3)據題意,混合溶液的PH為5.6,溶液顯弱酸性,則有 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
考點:化學平衡和電離平衡。考察化學平衡的影響因素以及電離平衡的影響因素。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
某學生為了探究鋅與鹽酸反應過程中速率變化。在100mL稀鹽酸中加入足量的鋅粉,標準狀況下測得數據累計值如下:
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是一種很好的燃料,工業上用CH4和H2O 為原料,通過反應I和Ⅱ來制備甲醇。
⑴將1.0 mol CH4和2.0 mol H2O(g)通人反應室(容積為100L),在一定條件下發生反應:
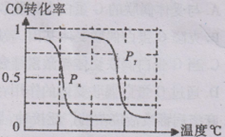
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的轉化率與溫度、壓強的關系如右圖所示。
CO(g)+3H2(g)……I。CH4的轉化率與溫度、壓強的關系如右圖所示。
①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為 。
②圖中的P1_ P2(填“<”、“>”或“=”),100℃時平衡常數為 。
③該反應的△H 0(填“<”、“>”或“=”)。
(2)在一定條件下,將a mol CO與3a mol H2的混合氣體在催化劑作用下能自發反應生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0 ……Ⅱ
CH3OH(g) △H<0 ……Ⅱ
④若容器容積不變,下列措施可增加甲醇產率的是
A.升高溫度 B.將CH3OH(g)從體系中分離
C.充人He,使體系總壓強增大 D.再充人lmol CO和3 mol H2
⑤為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中。
A.下表中剩余的實驗條件數據: a=_ ;b=_ 。
| 實驗編號 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“潔凈煤技術”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續產出了高熱值的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。生產煤炭氣的反應之一是:C(s)+H2O(g) CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。
(1)在容積為3L的密閉容器中發生上述反應,5min后容器內氣體的密度增大了0.12g/L,用H2O表示0~5miin的平均反應速率為_________________________。
(2)能說明該反應已達到平衡狀態的是________(選填編號)。
a.v正 (C)= v逆(H2O) b.容器中CO的體積分數保持不變
c.c(H2)=c(CO) d.炭的質量保持不變
(3)若上述反應在t0時刻達到平衡(如圖),在t1時刻改變某一條件,請在右圖中繼續畫出t1時刻之后正反應速率隨時間的變化: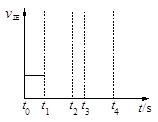
①縮小容器體積,t2時到達平衡(用實線表示);
②t3時平衡常數K值變大,t4到達平衡(用虛線表示)。
(4)在一定條件下用CO和H2經如下兩步反應制得甲酸甲酯:
①CO(g) + 2H2(g) CH3OH(g) ②CO(g) + CH3OH(g)
CH3OH(g) ②CO(g) + CH3OH(g) HCOOCH3(g)
HCOOCH3(g)
①反應①中CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。在不改變反應物用量的情況下,為提高CO的轉化率可采取的措施是 。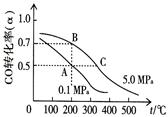
②已知反應①中CO的轉化率為80%,反應②中兩種反應物的轉化率均為85%,則5.04kgCO最多可制得甲酸甲酯 kg。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鉛及其化合物工業生產及日常生活具有非常廣泛的用途。
(1)瓦紐科夫法熔煉鉛,其相關反應的熱化學方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反應3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代數式表示)。
(2)還原法煉鉛,包含反應PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
| 溫度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溫度時,在3L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示。由圖中數據分析:
(1)該反應的化學方程式: ;
(2)反應開始至2min末,X的反應速率為 ;
(3)該反應是由 開始反應的。(?正反應?逆反應?正逆反應同時。)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.煤化工中常需研究不同溫度下平衡常數、投料比等問題。
已知:CO (g) +H2O(g) H2(g) +CO2(g)平衡常數K隨溫度的變化如下表:
H2(g) +CO2(g)平衡常數K隨溫度的變化如下表:
回答下列問題
(1)該反應的平衡常數表達式K=______,ΔH=______0(填“<”、“>”、“=”)
(2)已知在一定溫度下,CCs) +CO2(g) 2C0 Cg)平衡常數K1;
2C0 Cg)平衡常數K1;
C (s) +H2O(g) CO Cg) +H2(g)平衡常數K2
CO Cg) +H2(g)平衡常數K2
則K、K1 、K2,之間的關系是______:
(3)8000C時,向一個10L的恒容反應器中充入0.40molCO和1.60mol水蒸氣,經一段時 間后反應達到平衡,此時CO的轉化率為:若保持其他條件不變,向平衡體系中 再通入0.10molCO和0.40molCO2,此時v正______v逆 (填“>”、“=”或“<”)。
II.某小組利用H2C2O4溶液和酸性KMnO4溶液反應來探究“條件對化學反應速率的影響”。
(4) 向酸性KmnO4溶液中加入一定量的H2C2O4溶液,當溶液中的KmnO4耗盡后,紫色溶液將褪去。為確保能觀察到紫色褪去,H2C2O4與KmnO4初始的物質的量需要滿足的關 系為n(H2C2O4): n(KMnO4) ______。
(5) 為探究反應物濃度對化學反應速率的影響,該小組設計了如下實驗方案
表中x= ______ml ,理由是______。
(6) 已知50°C時,濃度c(H2C2O4)隨反應時間t的變化曲線如圖示,若保持其他條件不變,請在答題卡坐標圖 中畫出25°C時c(H2C2O4)隨t的變化曲線示意圖。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定溫度下,在1.0 L密閉容器中放入1 mol C(s)、1 mol H2O(g)進行反應,反應時間(t)與容器內氣體總壓強(p)的數據見下表:
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟,已知
SO2(g)+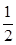 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某溫度下該反應的平衡常數K=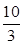 ,若在此溫度下,向100 L的恒容密閉容器中,充入3.0 mol
,若在此溫度下,向100 L的恒容密閉容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),則反應開始時v正 v逆(填“<”、“>”或“=”)。
(2)一定溫度下,向一帶活塞的體積為2 L的密閉容器中充入2.0 mol SO2和1.0 molO2,達到平衡后體積變為1.6 L,則SO2的平衡轉化率為 。
(3)在(2)中的反應達到平衡后,改變下列條件,能使SO2(g)平衡濃度比原來減小的是 (填字母)。
A保持溫度和容器體積不變,充入1.0 mol O2
B保持溫度和容器內壓強不變,充入1.0 mol SO3
C降低溫度
D移動活塞壓縮氣體
(4)若以右圖所示裝置,用電化學原理生產硫酸,寫出通入O2電極的電極反應式為 。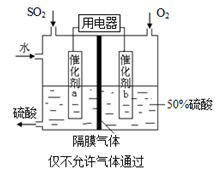
(5)為穩定持續生產,硫酸溶液的濃度應維持不變,則通入SO2和水的質量比為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com