
【題目】無水MgBr2可用作催化劑,實驗室采用鎂屑與液溴為原料制備無水MgBr2,裝置如圖,主要步驟如下:

步驟1三頸瓶中裝入10 g鎂屑和150 mL無水乙醚;裝置B中加入15mL液溴。
步驟2緩慢通入干燥的氮氣,直至溴完全導入三頸瓶中。
步驟3反應完畢后恢復至室溫,過濾,濾液轉移至另一干燥的燒瓶中,冷卻至0℃,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4常溫下用苯溶解粗品,冷卻至0℃,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至160℃分解得無水MgBr2產品。
已知:①Mg和Br2反應劇烈放熱;MgBr2具有強吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
請回答:
(1)儀器A的作用是______,實驗中不能用干燥空氣代替干燥N2,原因是______。
(2)如將裝置B改為裝置C,可能會導致的后果是______。

(3)步驟3中,第一次過濾除去的物質是______。
(4)有關步驟4的說法,正確的是______。
A.可用95%的乙醇代替苯溶解粗品
B.洗滌晶體可選用0℃的苯
C.加熱至160℃的主要目的是除去苯
D.該步驟的目的是除去乙醚和可能殘留的溴
【答案】干燥管 防止鎂屑與氧氣反應,生成的MgO阻礙Mg和Br2的反應 會將液溴快速壓入三頸瓶,反應過快大量放熱而存在安全隱患 鎂屑 BD
【解析】
(1)儀器A為干燥管,空氣中含氧氣會和鎂發生反應生成氧化鎂,阻礙鎂與溴單質的反應;
(2)將裝置B改為C裝置,當干燥的氮氣通入,會使氣壓變大,將液溴快速壓入三頸瓶,反應過快大量放熱存在安全隱患;
(3)反應完畢后恢復至常溫,過濾除去固體為鎂屑;
(4)根據物質的溶解性和實驗操作目的分析判斷。
(1)儀器A為干燥管,本實驗要用鎂屑和液溴反應生成溴化鎂,所以裝置中不能有能與鎂反應的氣體,如氧氣,否則Mg與O2反應產生的MgO覆蓋在Mg屑表面,會阻礙Mg和Br2的反應,因此不能用干燥的空氣代替干燥的氮氣;
(2)若將裝置B改為C裝置,當干燥的氮氣通入,會使錐形瓶中氣壓變大,將液溴快速壓入三頸瓶,反應過快,放出大量的熱,存在安全隱患,裝置B是利用干燥的氮氣將溴蒸氣帶入三頸瓶中,可以控制反應速度,防止反應過快;
(3)步驟3過濾出去的是不溶于水的鎂屑;
(4)A. 95%的乙醇中含有水,溴化鎂有強烈的吸水性,因此不能使用95%的乙醇溶解樣品,A錯誤;
B. 加入苯的目的是除去乙醚和溴,洗滌晶體用0℃的苯,溫度降低,可以減少產品的溶解,B正確;
C. 加熱至160℃的主要目的是分解三乙醚合溴化鎂得到溴化鎂,不是為除去苯,C錯誤;
D. 該步驟是為了除去溶劑乙醚及可能殘留的液溴,D正確;
故合理選項是BD。


科目:高中化學 來源: 題型:
【題目】已知:CH3—CH=CH2+HBr―→CH3—CHBr—CH3(主要產物)。1 mol某烴A充分燃燒后可以得到8molCO2和4mol H2O。該烴A在不同條件下能發生如圖所示的一系列變化。下列說法正確的是( )
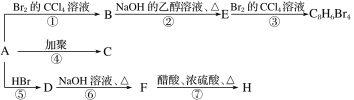
A.A的結構簡式C8H10
B.C的結構簡式![]()
C.D→F的反應類型是消去反應
D.B→E反應的化學方程式:![]() +NaOH
+NaOH![]()
![]() +NaBr
+NaBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“低碳經濟”是建設美麗中國的發展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常溫下,在合適催化劑的作用下,采用CH4和O2一步合成液態CH3OH的熱化學方程式為____。
(2) 二甲醚(CH3OCH3)是清潔能源。利用合成氣合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定條件下,在反應中CO的平衡轉化率α(CO)與溫度(T)、投料比n(H2)/n(CO)的關系如圖1所示,平衡常數K與溫度(T)的關系如圖2所示。
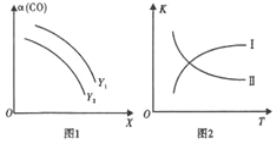
①圖1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②圖2中,曲線____(填I或II)符合平衡常數變化規律。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是一種重要的化工原料,常用作橡膠硫化劑,改變生橡膠受熱發粘、遇冷變硬的性質。查閱資料可知S2Cl2具有下列性質:
物理性質 | 毒性 | 色態 | 揮發性 | 熔點 | 沸點 |
劇毒 | 金黃色液體 | 易揮發 | -76℃ | 138℃ | |
化學性質 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高熱或與明火接觸,有引起燃燒的危險; ④受熱或遇水分解放熱,放出腐蝕性煙氣; | ||||
(1)制取少量S2Cl2
實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品。
①儀器m的名稱為___,裝置F中試劑的作用是___。
②裝置連接順序:A→___→E→D。
③實驗前打開K1,通入一段時間的氮氣排盡裝置內空氣。實驗結束停止加熱后,再通入一段時間的氮氣,其目的是___。
④為了提高S2Cl2的純度,實驗的關鍵是控制好溫度和___。
(2)①S2Cl2遇水強烈反應產生煙霧,其產物中有一種氣體X能使品紅溶液褪色,加熱后又恢復原狀,且反應過程中只有一種元素化合價發生變化,寫出該反應的化學方程式___。
②甲同學為了驗證兩種氣體產物,將水解生成的氣體依次通過硝酸銀與稀硝酸的混合溶液、品紅溶液、NaOH 溶液,該方案___(填“可行”或“不可行”),原因是___。
(3)某同學為了測定S2Cl2與水反應后生成的氣體X在混合氣體中的體積分數,設計了如下實驗方案:

①W溶液可以是___(填標號)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②該混合氣體中氣體X的體積分數為____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯化硼(BCl3)是一種重要的化工原料。實驗室制備BCl3的原理B2O3+3C+3Cl2![]() 2BCl3+3CO,某實驗小組利用干燥的氯氣和下列裝置(裝置可重復使用)制備BCl3并驗證反應中有CO生成。(已知:BCl3的熔點為-107.3℃,沸點為12.5℃;硝基苯的密度比水大)。請回答下列問題:
2BCl3+3CO,某實驗小組利用干燥的氯氣和下列裝置(裝置可重復使用)制備BCl3并驗證反應中有CO生成。(已知:BCl3的熔點為-107.3℃,沸點為12.5℃;硝基苯的密度比水大)。請回答下列問題:

實驗Ⅰ:制備BCl3并驗證產物CO
(1)該實驗裝置中合理的連接順序為G→______→______→______→______→F→D→I;其中裝置E的作用是______。
(2)BCl3接觸潮濕空氣時會形成白霧,請寫出該反應的化學方程式______。
(3)能證明反應中有CO生成的現象是______。
實驗Ⅱ:產品中氯含量的測定
①準確稱取少許m g產品,置于蒸餾水中完全水解,并配成100 mL溶液。
②取10.00 mL溶液于錐形瓶中
③加入V1 mL濃度為c1mol/L AgNO3溶液使氯離子完全沉淀;向其中加入少許硝基苯用力搖動。
④以硝酸鐵為指示劑,用c2 mol/LKSCN標準溶液滴定過量的AgNO3溶液。重復步驟②~④二次,達到滴定終點時用去KSCN溶液的平均體積為V2 mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步驟②移取溶液時所需儀器名稱為______,步驟④中達到滴定終點的現象為______。
(5)產品中氯元素的質量分數為______。
(6)下列操作,可能引起測得產品中氯含量偏高是______。
A.步驟③中未加硝基苯
B.步驟①中配制100 mL溶液時,定容時俯視刻度線
C.用KSCN溶液滴定剩余AgNO3溶液時,滴定前有氣泡,滴定后無氣泡
D.滴定剩余AgNO3溶液時,KSCN溶液滴到錐形瓶外面一滴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 用鹽酸標準溶液測定NaOH溶液濃度滴定實驗中,滴定前無氣泡而滴定后有氣泡,會使測定值偏高
B. 將地下鋼管與直流電源的正極相連,用來保護鋼管
C. 已知在101KPa下,1gH2燃燒生成水蒸氣放出121kJ熱量,其熱化學方程式為:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa時,強酸與強堿的稀溶液發生中和反應的中和熱為57.3kJ·mol-1,表示稀H2SO4與KOH溶液反應的中和熱的熱化學方程式為:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A.圖1表示0.001 mol·L一1鹽酸滴定0.001 mol·L一1NaOH溶液的滴定曲線
B.圖2所示,石墨的熔點比金剛石低
C.圖3表示的是Al3+與OH一反應時含鋁微粒濃度變化曲線,圖中a區域的物質是Al(OH)3
D.圖4所示,圖中的陰影部分面積的含義是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通常利用SiO2 和碳反應來制取硅,寫出反應的化學方程式___________________。
工業上還可以利用鎂制取硅,反應為2Mg+SiO2 = 2MgO+Si,同時會發生副反應:2Mg + Si = Mg2Si。如圖是進行Mg與SiO2反應的實驗裝置,試回答下列問題:

(1)由于O2和H2O(g)的存在對該實驗有較大影響,實驗中應通入氣體X作為保護氣,試管中的固體藥品可選用________(填序號)。
a.石灰石 b.鋅粒 c.純堿
(2)實驗開始時,必須先通一段時間X氣體,再加熱反應物,其理由是 ___________________________;當反應引發后,移走酒精燈,反應能繼續進行,其原因是______________________。
(3)反應結束后,待冷卻至常溫時,往反應后的混合物中加入稀鹽酸,可觀察到閃亮的火星,產生此現象的原因是副產物Mg2Si遇鹽酸迅速反應生成SiH4(硅烷)氣體,然后SiH4自燃.用化學方程式表示這兩個反應①________________________②___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近科學家獲得了一種穩定性好、抗氧化能力強的活性化合物A;其結構如下:

為了研究X的結構,將化合物A在一定條件下水解只得到 和C。經元素分析及相對分子質量測定,確定C的分子式為C7H6O3,C遇FeCl3水溶液顯紫色,與NaHCO3溶液反應有CO2產生。
和C。經元素分析及相對分子質量測定,確定C的分子式為C7H6O3,C遇FeCl3水溶液顯紫色,與NaHCO3溶液反應有CO2產生。
請回答下列問題:
(1)化合物B能發生下列哪些類型的反應________。
A.取代反應 B.加成反應
C.縮聚反應 D.氧化反應
(2)寫出化合物C所有可能的結構簡式______________________________。
(3)C可通過下圖所示途徑合成,并制取冬青油和阿司匹林。

(ⅰ)寫出有機物的結構簡式:D:______________,C:________________,E:______________。
(ⅱ)寫出變化過程中①、⑥的化學方程式(注明反應條件)
反應①__________________________________;反應⑥_____________________________。
(ⅲ)變化過程中的②屬于____________反應,⑦屬于________反應。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com