
【題目】已知NA為阿伏加德羅常數的值,下列敘述錯誤的有幾個( )
①BF3、CCl4中所有原子均達到最外層8電子穩定結構
②46g SiO2中含有共價鍵的數目為NA
③2g H218O和D2O的混合物中,含有的電子數為NA
④K2SO4溶于水的過程中有離子鍵、共價鍵的斷裂
⑤78g Na2O2中所含離子的數目為4NA
⑥18g D2O的中子數小于10NA
⑦1mol NH5中含有5NA個N—H鍵(已知NH5中所有原子都達到稀有氣體的穩定結構)
A.3B.4C.5D.6
【答案】C
【解析】
①BF3中B原子最外層只有6個電子,①錯誤;
②SiO2由原子構成,1mol SiO2中平均含4mol Si-O鍵,46g SiO2的物質的量為![]() ,含有共價鍵的物質的量為4×
,含有共價鍵的物質的量為4×![]() =
=![]() ,即含共價鍵數目為
,即含共價鍵數目為![]() NA,②錯誤;
NA,②錯誤;
③H218O和D2O的摩爾質量均為20g/mol,2g H218O和D2O的混合物的物質的量=![]() =0.1mol,每個H218O和D2O分子均含10個電子,故2g H218O和D2O的混合物所含電子的物質的量=0.1mol×10=1mol,即所含電子數為NA,③正確;
=0.1mol,每個H218O和D2O分子均含10個電子,故2g H218O和D2O的混合物所含電子的物質的量=0.1mol×10=1mol,即所含電子數為NA,③正確;
④K2SO4中K+和SO42-之間以離子鍵結合,溶于水電離出K+和SO42-,離子鍵斷裂,無共價鍵斷裂,④錯誤;
⑤Na2O2由Na+和O22-構成,78g Na2O2的物質的量為![]() =1mol,所以78g Na2O2中所含離子的物質的量=1mol×3=3mol,即含離子數目為3NA,⑤錯誤;
=1mol,所以78g Na2O2中所含離子的物質的量=1mol×3=3mol,即含離子數目為3NA,⑤錯誤;
⑥18g D2O的物質的量為![]() ,每個D2O分子的中子數=1×2+8×1=10,故18g D2O所含中子的物質的量為0.9mol×10=9mol,即中子數為9NA,小于10NA,⑥正確;
,每個D2O分子的中子數=1×2+8×1=10,故18g D2O所含中子的物質的量為0.9mol×10=9mol,即中子數為9NA,小于10NA,⑥正確;
⑦若1mol NH5中含有5NA個N—H鍵,則1和NH5分子中含5個N-H鍵,N原子最外層電子數為10,與NH5中所有原子都達到稀有氣體的穩定結構矛盾,⑦錯誤;
綜上所述,①②④⑤⑦錯誤,C滿足題意。答案選C。


科目:高中化學 來源: 題型:
【題目】從巴旦杏中提取有香味的有機物R,結構簡式如圖所示。下列有關R的說法錯誤的是
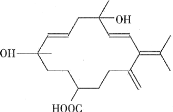
A.R既能與碳酸氫鈉溶液反應,又能與鈉粒反應
B.R能發生酯化、加成、氧化反應
C.R的羥基能在銅、加熱條件下與O2反應生成醛基
D.R的分子式為C21H32O4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fe、Co、Ni均為第Ⅷ族元素,它們的化合物在生產、生活中有著廣泛的應用。
(1)基態Co原子的價電子排布式為_______,Co2+核外3d能級上有_____對成對電子。
(2)Co3+的一種配離子[Co(N3)(NH3)5]2+中,Co3+的配位數是________。1 mol配離子中所含σ鍵的數目為________,配位體N3-中心原子的雜化類型為________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入過量氨水可生成更穩定的[Co(NH3)6]2+,其原因是_________________________________________________。
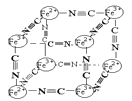
(4)某藍色晶體晶體結構如圖,Fe2+、Fe3+分別占據立方體互不相鄰的頂點,而立方體的每條棱上均有一個CN-,K+位于立方體的體心上。據此可知該晶體的化學式為________,立方體中Fe2+間連接起來形成的空間構型是________。K+空缺率(體心中沒有K+的占總體心的百分比)為_____________。
(5)NiO的晶胞結構如圖甲所示,其中原子坐標參數A為(0,0,0),B為(1,1,0),則C原子坐標參數為________。
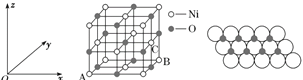
圖甲 圖乙
(6)一定溫度下,NiO晶體可以自發地分散并形成“單分子層”,可以認為O2-作密置單層排列,Ni2+填充其中(如圖乙),已知O2-的半徑為a pm,每平方米面積上分散的該晶體的質量為________g(用含a、NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向27.2gCu和Cu2O的混合物中加入某濃度的稀硝酸0.5L,固體物質完全反應,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此時溶液呈中性。金屬離子已完全沉淀,沉淀質量為39.2g。下列有關說法不正確的是
A. Cu與Cu2O的物質的量之比為2∶1 B. 硝酸的物質的量濃度為2.6mol/L
C. 產生的NO在標準狀況下的體積為4.48L D. Cu、Cu2O與硝酸反應后剩余HNO3為0.2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉常用作漂白劑、殺菌劑、消毒劑,能與水和二氧化碳等物質發生反應,保存不當時容易變質。某實驗小組以過氧化鈉為研究對象進行了如下實驗。
(1)探究一包Na2O2樣品是否已經變質:取少量樣品,將其溶解,加入__________溶液,充分振蕩后有白色沉淀,證明Na2O2已經變質。
(2)該實驗小組為了粗略測定過氧化鈉的質量分數,稱取了m g樣品,并設計用下圖裝置來測定過氧化鈉的質量分數。
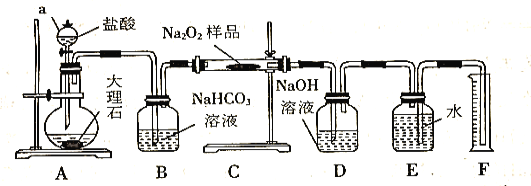
①裝置D的作用是_________________________________;
②將儀器連接好以后,必須進行的第一步操作是_________________________________;
③寫出裝置C中發生主要反應的化學方程式_________________________________;
④反應結束后,在讀取實驗中生成氣體的體積時,你認為合理的是_______________(填序號);
a.讀取氣體體積前,需冷卻到室溫
b.調整量筒使E、F內液面高度相同
c.視線與凹液面的最低點相平時讀取量筒中水的體積
⑤讀出量筒內水的體積后,將其折算成標準狀況下氧氣的體積為VmL,則樣品中過氧化鈉的質量分數為______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增加。A是元素Y的單質。常溫下,甲的濃溶液和A發生鈍化。丙、丁、戊是由這些元素組成的二元化合物,且丙是無色氣體。上述物質的轉化關系如圖所示。下列說法不正確的是( )
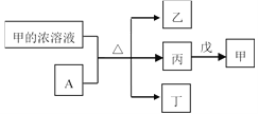
A.簡單離子半徑大小:X>Y
B.氣態氫化物的還原性:X<Z
C.丁和戊中所含元素種類相同
D.W的簡單離子與Z的簡單離子在水溶液中可大量共存
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按第26屆國際計量大會重新定義,阿伏加德羅常數(NA)有了準確值6.02214076×1023。下列說法正確的是( )
A.12gNaHSO4在熔融狀態下可以電離出的陽離子數目0.1NA
B.用23.5gAgI與水制成的膠體中膠體粒子數目為0.1NA
C.標準狀況下,2.24LCl2全部溶于水所得溶液中的Cl-與ClO-數目之和為0.2NA
D.1.0L18.4mol/LH2SO4溶液與足量銅在加熱的條件下反應,被還原的H2SO4分子數目為9.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)是極易溶于水且不與水發生化學反應的黃綠色氣體,沸點為11℃,某小組在實驗室中制備ClO2所用裝置如圖:[已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4]。
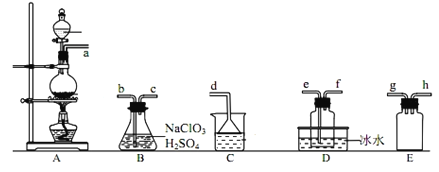
下列說法正確的是( )
A.裝置C中裝的是飽和食鹽水,a流出氣體為SO2
B.裝置D放冰水的目的是液化二氧化硫防止污染環境
C.連接裝置時,導管口a可接h或g,導管口c接e
D.可以選用裝置A利用3mo/L鹽酸與MnO2反應制備氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(13分)用輝銅礦(主要成分為 Cu2S,含少量Fe2O3、SiO2,等雜質)制備難溶于水的堿式碳酸銅的流程如下:
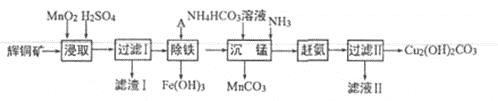
(1)下列措施是為了加快浸取速率,其中無法達到目的的是____(填字母)。
A.延長浸取時間 | B.將輝銅礦粉碎 |
C.充分攪拌 | D.適當增加硫酸濃度 |
(2)濾渣I巾的主要成分是MnO2、S、SiO2,請寫出“浸取”反應中生成S的離子方程式:_______。
(3)研究發現,若先除鐵再浸取,浸取速率明顯變慢,可能的原因是___________。
(4)“除鐵”的方法是通過調節溶液pH,使Fe3+轉化為Fe(OH)3,則加入的試劑A可以是_______(填化學式);“趕氨”時,最適宜的操作方法是________。
(5)“沉錳”(除Mn2+)過程中有關反應的離子方程式為_______。
(6)濾液Ⅱ經蒸發結晶得到的鹽主要是___________(填化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com