
【題目】硫和鈣的相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)鈣元素的焰色反應呈磚紅色,其中紅色對應的輻射波長為___nm(填字母)。
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一電離能較大的是________(填元素符號),其基態原子外圍電子排布式為________。其基態原子中電子的空間運動狀態有________種。
(3)硫的最高價氧化物的水合物硫酸能與肼反應生成N2H6SO4,N2H6SO4晶體類型與硫酸銨相同,則N2H6SO4的晶體內不存在________ (填字母)。
A.離子鍵 B.共價鍵 C.配位鍵 D.范德華力
(4)基態Ca原子中,核外電子占據最高能層的符號是________, 該能層為次外層時最多可以容納的電子數為________。鈣元素和錳元素屬于同一周期,且核外最外層電子構型相同,但金屬鈣的熔點、沸點等都比金屬錳低,原因是________________________。
(5)過氧化鈣晶體的晶胞結構如圖所示,已知該晶胞的密度是ρg·cm-3,則晶胞結構中最近的兩個Ca2+間的距離為______________________nm(列算式即可,用NA表示阿伏加德羅常數的數值)。與Ca2+緊鄰O22-的個數為________。

【答案】 E S 3s23p4 9 D N 18 Ca原子半徑較大且價電子數較少,金屬鍵較弱  6
6
【解析】(1)鈣元素的焰色反應呈磚紅色,其中紅色對應的輻射波長為700nm,故選E;
(2)S原子吸引電子的能力大于Ca原子,第一電離能較大的是S,S是16號元素,基態原子外圍電子排布式為3s23p4。S的基態原子中電子的空間運動狀態有1s、2s、2px、2py、2pz、3s、3px、3py、3pz,共9種空間運動狀態,故答案為:S;3s23p4;9;
(3)N2H6SO4和(NH4)2SO4都是離子晶體,N2H6 2+和SO42-之間存在離子鍵,N2H62+中N和H之間形成6個共價鍵(其中2個配位鍵),N和N之間形成共價鍵,SO42-中S和O之間形成共價鍵,不含范德華力,故選D;
(4)基態Ca原子含有4個電子層,核外電子占據最高能層的符號是N,原子核外次外層的電子數不超過18個。Ca原子半徑較大且價電子數較少,導致鈣中金屬鍵較弱,使得金屬鈣的熔點、沸點等都比金屬錳低,故答案為:N;18;Ca原子半徑較大且價電子數較少,金屬鍵較弱;
(5)根據晶胞結構圖,晶胞中Ca2+數為8×![]() +6×
+6×![]() =4,O22-的數為1+12×
=4,O22-的數為1+12×![]() =4。1mol晶胞的質量為4×72g,1mol晶胞的體積為
=4。1mol晶胞的質量為4×72g,1mol晶胞的體積為![]() =
=![]() cm3,則晶胞的邊長為
cm3,則晶胞的邊長為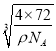 cm=
cm= ×107 nm,晶胞結構中最近的兩個Ca2+間的距離為晶胞邊長的
×107 nm,晶胞結構中最近的兩個Ca2+間的距離為晶胞邊長的![]() ,即距離為
,即距離為![]() ×
× ×107 nm;根據晶胞結構圖,與Ca2+緊鄰O22-的個數為6個,故答案為:
×107 nm;根據晶胞結構圖,與Ca2+緊鄰O22-的個數為6個,故答案為: ![]() ×
× ×107;6。
×107;6。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知下列反應的熱化學方程式為:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
則反應2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反應熱(焓變)為( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水中有非常豐富的化學資源,從海水中可提取多種化工原料。某工廠對海水資源綜合開發利用的部分工藝流程圖如下。回答下列問題:

(1)精制食鹽水時下列物質中,用到的有______________________(填序號)。
①NaOH溶液 ②鹽酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工業上經過②、③、④制備Ba2。步驟②中Cl2氧化Br-應在________(填酸性或堿性)條件下進行;步驟③Br2可用熱空氣吹出,其原因是_____________________。
(3)為了除去工業Br2中微量的Cl2,可向工業Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步驟⑤所得Mg(OH)2沉淀中混有Ca(OH)2雜質,寫出除去雜質的實驗步驟 ________________(寫出加入的試劑和操作)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是:

A. 用圖(a)所示裝置除去氯氣中含有的少量氯化氫
B. 用圖(b)所示裝置蒸發氯化鈉溶液制備氯化鈉晶體
C. 用圖(c)所示裝置制取少量純凈的二氧化碳氣體
D. 用圖(d)所示裝置分離苯萃取碘水后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室有一瓶混有氯化鈉的氫氧化鈉固體試劑,經測定NaOH的質量分數約為82.0%,為了驗證其純度,用濃度為0.2mol/L的鹽酸進行滴定,試回答:
(1)托盤天平稱量5.0g固體試劑,用蒸餾水溶解于燒杯中,并振蕩,然后立即直接轉入500mL容量瓶中,恰好至刻度線,配成待測液備用.請改正以上操作中出現的五處錯誤.① , ② , ③ , ④ , ⑤ .
(2)將標準鹽酸裝在25.00mL滴定管中,調節液面位置在處,并記下刻度.
(3)取20.00mL待測液,待測定.該項實驗操作的主要儀器有 . 用試劑作指示劑時,滴定到溶液顏色由剛好至色時為止.
(4)滴定達終點后,記下鹽酸用去20.00mL,計算NaOH的質量分數為 .
(5)試分析滴定偏低誤差可能由下列哪些實驗操作引起的 .
A.轉移待測液至容量瓶時,未洗滌燒杯
B.酸式滴定管用蒸餾水洗滌后,直接裝鹽酸
C.滴定時,反應容器搖動太激烈,有少量液體濺出
D.滴定到終點時,滴定管尖嘴懸有液滴
E.讀數(滴定管)開始時仰視,終點時俯視.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廢催化劑含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同學用10.0g該廢催化劑為原料,回收鋅和銅。采用的實驗方案如下,回答下列問題:

已知:金屬Zn 與Al類似,都是兩性金屬,能溶于強堿并放出氫氣,但鋁不溶于氨水,鋅卻可以溶于氨水形成四氨合鋅配離子[Zn(NH3)4]2+。
(1)濾液1中含有Fe2+,選用提供的試劑進行檢驗,檢驗方法如下:__________________________。(提供的試劑:稀鹽酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)濾渣2 除SiO2 外的另一成分是____________;第二次浸出時,加熱溫度不宜過高的原因是___________________;寫出第二次浸出的化學反應方程式____________________________________。寫出鋅溶于氨水的離子方程式____________________________________。
(3)ZnSO4在水中的溶解度,隨溫度的升高而緩慢增大,從硫酸鋅溶液得到七水硫酸鋅晶體,可采用的方法是_____________________;析出七水硫酸鋅晶體,減壓過濾,用于淋洗七水硫酸鋅晶體的溶劑是___________________;某同學在實驗完成之后,得到5.74gZnSO4·7H2O(式量287)則鋅的回收率為_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有24mL濃度為0.05mol·L-1的Na2SO3溶液恰好與20mL濃度為0.02mol·L-1的K2Cr2O7溶液完全反應。已知Na2SO3可被K2Cr2O7氧化為Na2SO4,則元素Cr在還原產物中的化合價為( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有pH為13的Ba(OH)2、NaOH的混合液100mL,從中取出24mL.用0.025mol/LH2SO4滴定,當滴定至沉淀不再增加時,所消耗的酸的體積是滴定至終點所耗酸體積的一半.求:①當滴到沉淀不再增加時(溶液體積變化忽略不計),溶液的pH=________(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=________和c(NaOH)=________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列說法不正確的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次減小
B.a 點可表示MnCO3 的飽和溶液,且c(Mn2+)=c(CO32﹣)
C.b 點可表示的CaCO3不飽和溶液,且c(Ca2+)<c(CO32﹣)
D.c 點可表示MgCO3 的不飽和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com