
【題目】實驗室用MnO2和濃鹽酸制氯氣的反應為MnO2+4HCl(濃)![]() MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g MnO2被還原,那么:
MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g MnO2被還原,那么:
(1)產生的Cl2在標準狀況下的體積為__________;
(2)轉移電子的物質的量為_______________;
(3)紡織工業中常用氯氣作漂白劑,漂白布匹后,過量的氯需要除去,通常可用Na2SO3作“脫氯劑”,脫氯后的產物為Na2SO4,氯變為-1價。若把本題中產生的Cl2完全轉化,需要Na2SO3的質量為____________________________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】常溫下,分別調節濃度均為0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量為![]() ×100%)與pH的變化關系如圖所示。已知調節pH時不影響溶液總體積。下列說法不正確的是
×100%)與pH的變化關系如圖所示。已知調節pH時不影響溶液總體積。下列說法不正確的是
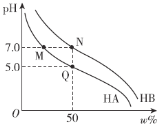
A.常溫下,Ka(HA)=1.0×10-5B.M、N兩點對應離子濃度:c(A-)=c(B-)
C.將M、N兩點溶液等體積混合,溶液呈中性D.水的電離程度:M=N>Q
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如圖所示,下列說法錯誤的是
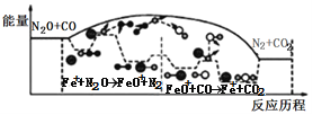
A.反應總過程是放熱的
B.Fe+作為催化劑改變了反應途徑,提高了反應速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 兩步反應均為放熱反應
D.若反應在恒容密閉容器中進行,溫度越高,反應速率一定越快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,反應2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中進行,達到化學平衡的標志是( )
3C(g)+D(g)在恒容容器中進行,達到化學平衡的標志是( )
A. 單位時間內生成2n molB,同時消耗3n molCB. 容器內壓強不隨時間變化
C. 混合氣體的密度不隨時間變化D. B物質的百分含量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,相同濃度的兩種一元酸HX、HY分別用同一濃度的NaOH標準溶液滴定,滴定曲線如圖所示。下列說法正確的是![]()
![]()
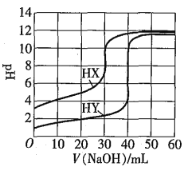
A.HX、HY起始溶液體積相同
B.均可用甲基橙作滴定指示劑
C.pH相同的兩種酸溶液中:![]()
D.同濃度KX與HX的混合溶液中,粒子濃度間存在關系式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈦在航天、潛海和醫療方面應用廣泛。以鈦鐵礦[主要成分為鈦酸亞鐵(FeTiO3),含少量Fe2O3]為原料制備鈦的工藝流程如圖所示。
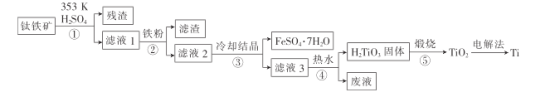
(1)步驟②、③、④中,均需進行的操作是_____________(填操作名稱)。
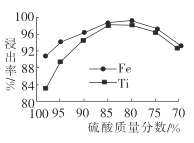
(2)濾液1中鈦元素以TiO2+形式存在,步驟①中生成TiO2+的化學方程式為__________,硫酸質量分數對鈦、鐵浸出率的影響如圖所示.據此判斷,酸浸時所加硫酸的質量分數應為______(填范圍)。.
(3)請結合離子方程式解釋步驟④中加熱水的原因:__________。
(4)電解法制備Ti的裝置是以石墨為陽極,TiO2為陰極,熔融CaO為電解質。Ti在_______(填“陽極”或“陰極”)生成,____(填“能”或“不能”)將熔融CaO換成石灰乳。
(5)以綠礬為原料,可以制備重要工業原料氧化鐵,基本流程如下:
![]()
①綠礬溶液中離子濃度由大到小的順序為__________。
②FeCO3達到沉淀溶解平衡時,室溫下測得溶液的pH為8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2.9 g鎂鋁合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的體積是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2015年斯坦福大學研究人員研制出一種可在一分鐘內完成充放電的超常性能鋁離子電池,內部用AlCl4–和有機陽離子構成電解質溶液,其放電工作原理如下圖所示。下列說法不正確的是
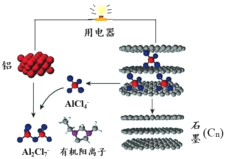
A.放電時,鋁為負極、石墨為正極
B.放電時,有機陽離子向鋁電極方向移動
C.放電時的負極反應為:Al –3e- + 7AlCl4– = 4Al2Cl7–
D.充電時的陽極反應為:Cn + AlCl4––e- = CnAlCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】證明鹵族元素的非金屬性強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢查)。
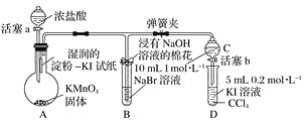
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ.當B中溶液由黃色變為棕紅色時,關閉活塞a。
Ⅳ.……
(1)驗證氯氣的氧化性強于碘的實驗現象是________________________________________。
(2)B中溶液發生反應的離子方程式是____________________________________________。
(3)為驗證溴的氧化性強于碘,過程 Ⅳ 的操作和現象是____________________________。
(4)過程Ⅲ實驗的目的是________________________________________________________。
(5)氯、溴、碘單質的氧化性逐漸減弱的原因:同主族元素從上到下,原子半徑逐漸________,得電子能力逐漸________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com