解:(1)物質(zhì)的量濃度c=

=
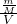
=
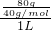
=2mol/L,故答案為:2mol/L;
(2)電解飽和食鹽水的反應(yīng)為化:2NaCl+2H
2O

2NaOH+Cl
2↑+H
2↑,化合價升高值=化合價降低值=轉(zhuǎn)移電子數(shù)=2,電子轉(zhuǎn)移情況為:
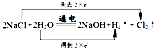
,碳酸鈣在高溫下會分解,故答案為:
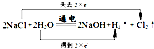
;高溫;
(3)有元素化合價變化的反應(yīng)為氧化還原反應(yīng),流程III中發(fā)生兩個反應(yīng),一個是氯氣和氫氧化鈣反應(yīng)生成氯化鈣、水以及次氯酸鈣的反應(yīng),即2Cl
2+2Ca(OH)
2═Ca(ClO)
2+CaCl
2+2H
2O,屬于氧化還原反應(yīng),一個是次氯酸鈣和水以及二氧化碳反應(yīng)生成碳酸鈣和次氯酸的反應(yīng),即Ca(ClO)
2+CO
2+H
2O═CaCO
3+2HClO,屬于復(fù)分解反應(yīng),一定不是氧化還原反應(yīng),
故答案為:2Cl
2+2Ca(OH)
2═Ca(ClO)
2+CaCl
2+2H
2O;
(4)流程IV中加水溶解后過濾可以實現(xiàn)固體難溶物和液體的分離,故答案為:過濾;
(5)較純的次氯酸鈣粉末必須密封保存,因為氯酸鈣以和空氣中的水以及二氧化碳反應(yīng)而變質(zhì),即Ca(ClO)
2+CO
2+H
2O═CaCO
3+2HClO,故答案為:Ca(ClO)
2+CO
2+H
2O═CaCO
3+2HClO.
分析:(1)根據(jù)物質(zhì)的量濃度計算公式c=

=
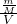
來計算;
(2)氧化還原反應(yīng)中,化合價升高值=化合價降低值=轉(zhuǎn)移電子數(shù);碳酸鈣在高溫下會分解;
(3)有元素化合價變化的反應(yīng)是氧化還原反應(yīng),化合價升高元素所在的反應(yīng)物是還原劑,化合價降低元素所在的反應(yīng)物是氧化劑;
(4)實現(xiàn)固體和液體的分離方法是過濾;
(5)氯酸鈣以和空氣中的水以及二氧化碳反應(yīng).
點評:本題是一道綜合知識的考查題目,要求學(xué)生具有分析和解決問題的能力,難度大,綜合性強.

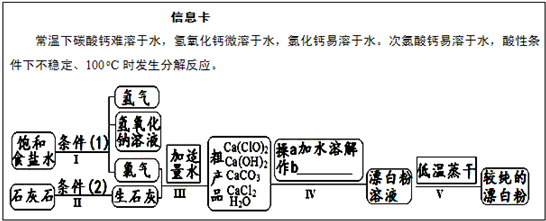
 =
=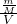 =
=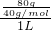 =2mol/L,故答案為:2mol/L;
=2mol/L,故答案為:2mol/L; 2NaOH+Cl2↑+H2↑,化合價升高值=化合價降低值=轉(zhuǎn)移電子數(shù)=2,電子轉(zhuǎn)移情況為:
2NaOH+Cl2↑+H2↑,化合價升高值=化合價降低值=轉(zhuǎn)移電子數(shù)=2,電子轉(zhuǎn)移情況為: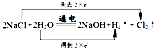 ,碳酸鈣在高溫下會分解,故答案為:
,碳酸鈣在高溫下會分解,故答案為: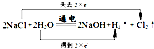 ;高溫;
;高溫; =
=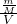 來計算;
來計算;
