
【題目】下列表示對應化學反應的離子方程式正確的是( )
A. 等物質的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
B. 用兩個銅電極電解CuSO4溶液:2Cu2++2H2O![]() 2Cu↓ +O2 ↑ +4H+
2Cu↓ +O2 ↑ +4H+
C. 硫酸氫鈉溶液與氫氧化鋇溶液恰好反應呈中性:H++SO![]() +Ba2++OH-===H2O+BaSO4↓
+Ba2++OH-===H2O+BaSO4↓
D. 向含有0.1 mol溶質的硫酸亞鐵稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O===4Fe(OH)3+8Na++O2↑
【答案】D
【解析】A.等物質的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++4OH-+2H+═Mg(OH)2↓+2H2O,故A錯誤;B.用銅電極電解CuSO4溶液時,陽極為銅本身失電子變成銅離子,陰極溶液中的銅離子在陰極析出,這時相當于電鍍裝置,沒有水參與電解,故B錯誤;C.硫酸氫鈉溶液與氫氧化鋇溶液恰好反應呈中性,硫酸氫鈉與氫氧化鋇按照物質的量2:1反應,反應的離子方程式為:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故C錯誤;D.過氧化鈉和水反應生成氫氧化鈉和氧氣,氧氣氧化亞鐵離子為三價鐵離子,和氫氧化鈉生成氫氧化鐵沉淀;向含有0.1 mol溶質的硫酸亞鐵稀溶液中加入7.8 g Na2O2,Na2O2的物質的量為0.1mol,亞鐵離子和過氧化鈉等物質的量反應,離子方程式為:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑,故D正確;故答案為D。


科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是( )
A. 將Al條投入NaOH溶液中:Al+OH-+H2O===AlO![]() +H2↑
+H2↑
B. 氯氣和水反應:Cl2+H2O === 2H++Cl-+ClO-
C. 碳酸氫鈣溶液中加入過量的氫氧化鈉溶液:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 硫酸銨溶液和氫氧化鋇溶液反應:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2 NH3·H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,N2與H2反應過程中的能量變化如圖所示。下列敘述正確的是
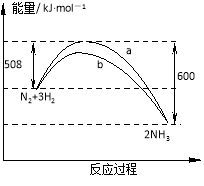
A.a曲線是加入催化劑時的能量變化曲線
B.在密閉容器中加入1 mol N2、3 mol H2,充分反應放出的熱量小于92 kJ
C.由圖可知,斷開1mol 氮氮三鍵與1 mol 氫氫鍵吸收的能量和小于形成1mol 氮氫鍵所放出的能量
D.反應物的總能量低于生成物的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,某恒容容器內進行可逆反應A(氣)+3B(氣)![]() 2C(氣)。下列說法正確的是( )
2C(氣)。下列說法正確的是( )
A. 化學反應的限度與反應時間的長短有關
B. 達化學平衡狀態時,C的生成速率是A的生成速率的2倍
C. 達化學平衡狀態時,容器內A、B、C的分子數比一定為1:3:2
D. 充入lmol A和3mol B,達化學平衡狀態時可生成2 mol C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵(PFS)是水處理中重要的絮凝劑,以廢鐵屑為原料制備PFS的具體工藝流程如下:
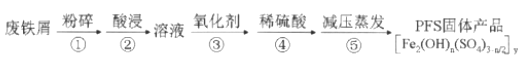
下列說法不正確的是( )
A. 步驟①,粉碎的目的是增大反應物接觸面積,提高“酸浸”反應速率
B. 步驟③,可選用H2O2、Cl2、KMnO4等氧化劑將Fe2+轉化為Fe3+
C. 步驟④,加稀硫酸調節pH在一定范圍內,若pH偏小則Fe3+水解程度太弱,若pH偏大時則形成Fe(OH)3沉淀
D. 步驟⑤,減壓蒸發,有利于降低蒸發溫度防止產物分解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com