
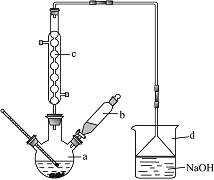
【題目】溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步驟回答問題:
(1)在a中加入15mL無水苯和少量鐵屑。在b中小心加入4.0mL液態溴。向a中滴入幾滴溴,有白色煙霧產生,是因為生成了______氣體。該反應為_______(填“吸熱”或“放熱”)反應,冷卻水流向是_____________(填“上進下出”或“下進上出”),繼續滴加至液溴滴完。其中儀器c的名稱是________,其作用是:__________________________________。裝置d的作用是:_____________________________________________________;燒瓶中發生的有機反應的方程式為:_______________________________________________。
(2)液溴滴完后,經過下列步驟分離提純:
①向a中加入10mL水,然后過濾除去未反應的鐵屑;
②濾液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗滌。洗滌、分離有機和無機試劑,需要用到的儀器是:_____________。第一次水洗除去大部分的HBr;用NaOH溶液洗滌的作用是______________;第二次水洗的目的是:____________;每一次洗滌,有機層從_________(填“下口放出”或“上口倒出”),棕黃色的溴苯經過提純后恢復為無色。
③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾。加入氯化鈣的目的是_____________。
(3)經以上分離操作后,粗溴苯中還含有的主要雜質苯,要進一步提純,下列操作中必須的是____(填入正確選項前的字母)。
A.蒸餾 B.滲析 C.分液 D.萃取
【答案】HBr 放熱 下進上出 球形冷凝管 冷凝回流溴和苯,減少原料揮發損失 吸收HBr和Br2,防止污染環境,同時可以防止倒吸 ![]() +Br2
+Br2![]()
![]() +HBr 分液漏斗 除去Br2和少量的HBr 除去NaOH 下口放出 吸收水分 A
+HBr 分液漏斗 除去Br2和少量的HBr 除去NaOH 下口放出 吸收水分 A
【解析】
(1)苯與液溴在鐵或溴化鐵作催化劑下發生取代反應,即反應方程式為![]() +Br2
+Br2![]()
![]() +HBr,HBr氣體遇到水蒸氣會產生白霧,即白霧是HBr;苯與液溴發生反應是放熱反應;為了增加冷卻效果,即冷卻水流向是下進上出;儀器c為球形冷凝管,冷凝管的作用是冷凝揮發出來的苯和液溴,并使它們流回到三頸燒瓶中,提高反應的轉化率,減少原料揮發損失;苯與液溴反應生成HBr,苯的鹵代反應是放熱反應,液溴易揮發,因此尾氣中有HBr及揮發出的Br2,用氫氧化鈉溶液吸收,防止污染大氣,所以裝置d的作用是吸收HBr和Br2,同時用倒扣的漏斗防止倒吸;發生的反應方程式為
+HBr,HBr氣體遇到水蒸氣會產生白霧,即白霧是HBr;苯與液溴發生反應是放熱反應;為了增加冷卻效果,即冷卻水流向是下進上出;儀器c為球形冷凝管,冷凝管的作用是冷凝揮發出來的苯和液溴,并使它們流回到三頸燒瓶中,提高反應的轉化率,減少原料揮發損失;苯與液溴反應生成HBr,苯的鹵代反應是放熱反應,液溴易揮發,因此尾氣中有HBr及揮發出的Br2,用氫氧化鈉溶液吸收,防止污染大氣,所以裝置d的作用是吸收HBr和Br2,同時用倒扣的漏斗防止倒吸;發生的反應方程式為![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(2)②分離有機和無機試劑,采用的方法是分液,需要用到的儀器是分液漏斗;純凈的溴苯為無色,實驗中制備的溴苯,因溶解Br2而顯褐色,因此洗滌時加入NaOH的目的是把未反應的Br2轉化成NaBr和NaBrO,以及除去少量的HBr;第二次水洗的目的是除去過量的NaOH;溴苯的密度大于水,因此每一次洗滌,有機層從下口放出;
③無水氯化鈣為干燥劑,加入氯化鈣的目的是吸收水分,干燥溴苯;
(3)苯是良好的有機溶劑,溴苯和苯互溶,進一步提純,需要采用蒸餾的方法進行,故A正確。


科目:高中化學 來源: 題型:
【題目】從海帶中提取碘單質,成熟的工藝流程如下,下列關于海水制碘的說法,正確的是( )
干海帶![]() 海帶灰
海帶灰![]() 懸濁液
懸濁液![]() 濾液
濾液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液![]() I2
I2
A. 實驗室在蒸發皿中灼燒干海帶,并且用玻璃棒攪拌
B. 含I-的濾液中加入稀硫酸和過氧化氫后,碘元素發生還原反應
C. 在碘水中加入幾滴淀粉溶液,溶液變藍色
D. 碘水加入CCl4得到I2的CCl4溶液,該操作為“萃取”
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某澄清透明的溶液中,下列各組離子中能大量共存的是
A. I-、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某物質灼燒時,焰色反應為黃色,下列判斷中正確的是
A. 該物質一定是鈉的化合物 B. 該物質一定含鈉元素
C. 可以確定該物質中不含鉀元素 D. 該物質一定是金屬鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00 mol·L-1、2.00 mol·L-1,大理石有細顆粒與粗顆粒兩種規格,實驗溫度為298 K、308 K,每次實驗HNO3的用量為25.0 mL、大理石用量為10.00 g。
(1)請完成以下實驗設計表,并在實驗目的一欄中填出對應的實驗編號:
實驗編號 | T/K | 大理石規格 | HNO3濃度/mol·L-1 | 實驗目的 |
① | 298 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究HNO3濃度對該反應速率的影響; (Ⅱ)實驗①和③探究溫度對該反應速率的影響; (Ⅲ)實驗①和④探究大理石規格(粗、細)對該反應速率的影響; |
② | _____ | _____ | _____ | |
③ | _____ | _____ | _____ | |
④ | _____ | _____ | _____ |
(2)實驗裝置如圖1所示,如何檢驗該裝置的氣密性________________________________

(3)實驗①中CO2質量隨時間變化的關系見下圖2:依據反應方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,計算實驗①在70-90 s范圍內HNO3的平均反應速率________________________
(4)請在答題卡的框圖中,畫出實驗②、③和④中CO2質量隨時間變化關系的預期結果示意圖。_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“84”消毒液在日常生活中使用廣泛,該消毒液無色,有漂白作用.它的有效成分是下列物質中的一種,這種物質是:
A.Na2O2B.NaOHC.KMnO4D.NaClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,水的電離可達到平衡:H2O ![]() H++OH- △H>0,下列敘述正確的是( )
H++OH- △H>0,下列敘述正確的是( )
A. 向水中加入稀氨水,平衡逆向移動,c(OH-)降低
B. 將水加熱,Kw增大,pH不變
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不變
D. 向水中加入少量冰醋酸,平衡逆向移動,c(H+)降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄酒中的酒精是葡萄果實中的糖發酵后的產物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ、已知:實驗室制乙烯原理為CH3CH2OH![]() CH2=CH2↑+H2O,產生的氣體能使Br2的四氯化碳溶液褪色,甲、乙同學用下列實驗驗證。(氣密性已檢驗,部分夾持裝置略)。
CH2=CH2↑+H2O,產生的氣體能使Br2的四氯化碳溶液褪色,甲、乙同學用下列實驗驗證。(氣密性已檢驗,部分夾持裝置略)。

實驗操作和現象:
操 作 | 現 象 |
點燃酒精燈,加熱至170℃ | Ⅰ:A中燒瓶內液體漸漸變黑 |
…… | |
實驗完畢,清洗燒瓶 | Ⅲ:A中燒瓶內附著少量黑色顆粒狀物,有刺激性氣味逸出 |
(1)溶液“漸漸變黑”,說明濃硫酸具有 性。
(2)分析,甲認為是C2H4,乙認為不能排除SO2的作用。
①根據甲的觀點,使B中溶液褪色反應的化學方程式是 ;
②乙根據現象認為實驗中產生的SO2和 ,使B中有色物質反應褪色。
③為證實各自觀點,甲、乙重新實驗,設計與現象如下:
甲:在A、B間增加一個裝有某種試劑的洗氣瓶;現象:Br2的CCl4溶液褪色。
乙:用下列裝置按一定順序與A連接:(尾氣處理裝置略)

現象:C中溶液由紅棕色變為淺紅棕色時,E中溶液褪色。
請回答下列問題:
a.甲設計實驗中A、B間洗氣瓶中盛放的試劑是 ;乙設計的實驗D中盛放的試劑是 ,裝置連接順序為 。
b.能說明確實是SO2使E中溶液褪色的實驗是 。
c.乙為進一步驗證其觀點,取少量C中溶液,加入幾滴BaCl2溶液,振蕩,產生大量白色沉淀,淺紅棕色消失,發生反應的離子方程式是 。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化劑。
(3)0.5molNa2S2O5溶于水配成1L溶液,該溶液的pH=4.5。溶液中部分微粒濃度隨溶液酸堿性變化如圖所示。寫出Na2S2O5溶于水時發生的化學方程式 。

(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空氣氧化的該溶液的pH調為10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此時溶液中c(SO32-)≤ mol·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com