
【題目】以粉煤灰(主要含Al2O3、SiO2,還有少量的Fe2O3)為原料制取Al2O3的流程如下:
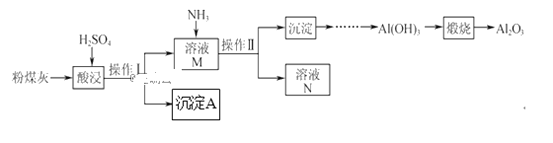
(1)操作Ⅰ的名稱是__。
(2)用H2SO4“酸浸”時的離子方程式為__(任寫一個)。
(3)簡述如何檢驗酸浸后溶液中是否有Fe3+__。
(4)“煅燒”時的化學方程式為__。
(5)沉淀A與氫氟酸反應的化學方程式為__。
【答案】過濾 Fe2O3+6H+=2Fe3++3H2O(或Al2O3+6H+=Al3++3H2O任寫一個) 取適量該溶液于試管中,加入KSCN,若變紅則有Fe3+ 2Al(OH)3![]() Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
【解析】
粉煤灰(主要含Al2O3、SiO2, 還有少量的Fe2O3)和稀硫酸混合,發(fā)生反應Al2O3+3H2SO4═Al2(SO4)3+3H2O,Fe2O3+3H2SO4═Fe 2(SO4)3+3H2O,SiO2和稀硫酸不反應,過濾溶液得濾渣Ⅰ為SiO2; 根據(jù)Fe3+遇KSCN溶液變紅色檢驗溶液中是否有Fe3+;Al(OH)3加熱分解為Al2O3和水;SiO2與氫氟酸反應生成SiF4和水。
(1)操作Ⅰ實現(xiàn)了固體SiO2和溶液的分離,操作Ⅰ的名稱是過濾。
(2)用H2SO4“酸浸”時Al2O3、Fe2O3與硫酸反應,反應的離子方程式分別為Al2O3+6H+=Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)Fe3+遇KSCN溶液變紅色,檢驗溶液中是否有Fe3+的方法是:取適量該溶液于試管中,加入KSCN,若變紅則有Fe3+。
(4)“煅燒”時Al(OH)3分解為Al2O3和水,化學方程式為2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
(5)沉淀A是SiO2,SiO2與氫氟酸反應生成SiF4和水,化學方程式為SiO2+4HF=SiF4↑+2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】自然界中時刻存在著氮的轉(zhuǎn)化。實現(xiàn)氮按照一定方向轉(zhuǎn)化一直是科學領域研究的重要課題,如圖為N2分子在催化劑的作用下發(fā)生的一系列轉(zhuǎn)化示意圖:
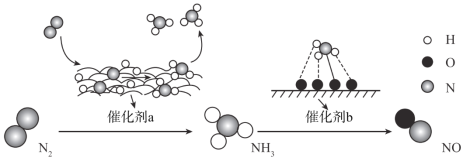
下列敘述正確的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均屬于氮的固定
NO均屬于氮的固定
B.催化劑a作用下氮原子發(fā)生了氧化反應
C.催化劑a、b表面均發(fā)生了極性共價鍵的斷裂
D.使用催化劑a、b均可以提高單位時間內(nèi)生成物的產(chǎn)量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(H2C2O4)是一種二元弱酸,在菠菜、莧菜、甜菜等植物中含量較高。25℃時,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示 ![]() 或
或![]() 隨pH的變化關系如圖所示。下列說法不正確的是 ( )
隨pH的變化關系如圖所示。下列說法不正確的是 ( )
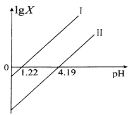
A.直線I中X表示的是![]()
B.直線I、Ⅱ的斜率均為1
C.0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4)
D.已知:25℃時,NH3·H2O的電離常數(shù)為10-4.69,則(NH4)2C2O4溶液呈堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應A2(g) + B2(g)=2AB(g) 的能量變化如圖所示,下列敘述中正確的是( )
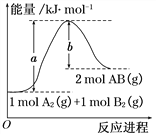
A.每生成2mol AB(g) 共吸收b kJ熱量
B.該反應熱ΔH = +(a-b) kJ·mol-1
C.反應物的總能量大于生成物的總能量
D.斷裂1 mol A—A鍵,放出a kJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在不同溫度下,水溶液中-lg c(H+)與-lg c(OH)。關系如圖所示。下列說法不正確的是( )
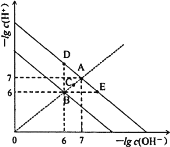
A.圖中五點Kw間的關系:B>C>A=D=E
B.A→E點對應的水溶液中,可能有NH4+、Ba2+、Cl、I大量同時存在
C.若0.1mol·L1的NaHA溶液水溶液中c(H+)與c(OH)關系如圖D點所示,則溶液中有:c(HA)>c(OH)>c(A2)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,當c(H+)與c(OH)關系如圖E點所示,則溶液中反應:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴乙烷在不同溶劑中與NaOH發(fā)生不同類型的反應,生成不同的反應產(chǎn)物。
某同學依據(jù)溴乙烷的性質(zhì),用如圖實驗裝置(鐵架臺、酒精燈略)驗證取代反應和消去反應的產(chǎn)物,請你一起參與探究。
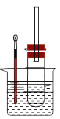
實驗操作Ⅰ:在試管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振蕩。
實驗操作II:將試管如圖固定后,水浴加熱。
(1)用水浴加熱而不直接用酒精燈加熱的原因是_______________________________。
(2)觀察到_________________________現(xiàn)象時,表明溴乙烷與NaOH溶液已完全反應。
(3)鑒定生成物中乙醇的結(jié)構,可用的波譜是_________________________________。
(4)為證明溴乙烷在NaOH乙醇溶液中發(fā)生的是消去反應,在你設計的實驗方案中,需要檢驗的是______________________,檢驗的方法是_____________(需說明:所用的試劑、簡單的實驗操作及預測產(chǎn)生的實驗現(xiàn)象)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組研究大小相同、過量的去膜鎂條與40mL0.1mol·L1的鹽酸和醋酸分別反應,相同條件下測得氣體體積與反應時間關系如下表所示:
氣體讀數(shù)/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(鹽酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列說法不正確的是( )
A.0~5mL時,A與B反應速率不同的原因是c(H+)不同所致
B.5~10mL時,A瓶平均反應速率為![]() mL·s1
mL·s1
C.0~20mL時,A瓶反應速率增大,可能是溫度升高所致
D.0~45mL時段內(nèi),鎂與鹽酸反應的速率始終大于鎂與醋酸反應的速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2H2(g)+O2(g)═2H2O(g)△H1
3H2(g)+Fe2O3(s)═2Fe(s)+3H2O(g)△H2
2Fe(s)+![]() O2(g)═Fe2O3(s)△H3
O2(g)═Fe2O3(s)△H3
2Al(s)+![]() O2(g)═Al2O3(s)△H4
O2(g)═Al2O3(s)△H4
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H5
下列關于上述反應焓變的判斷正確的是( )
A.△H1<0,△H3>0B.△H5<0,△H4<△H3
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據(jù)事實,寫出下列反應的熱化學方程式。
(1)已知拆開1molH-H鍵,1molN-H鍵,1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為___。
(2)已知稀溶液中,1molH2SO4與NaOH溶液恰好完全反應時,放出114.6kJ熱量,寫出表示H2SO4與NaOH反應的中和熱的熱化學方程式___。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com