
【題目】某溫度下,HNO2和CH3COOH的電離常數分別為5.0×10-4和1.7×10-5。將pH和體積均相同的兩種酸溶液分別稀釋,其pH隨加水體積的變化如圖所示。下列敘述正確的是
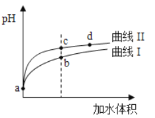
A. 溶液中水的電離程度:b點>c點
B. 曲線Ⅱ代表CH3COOH
C. 相同體積a點的兩溶液分別與NaOH恰好中和后,溶液中n(Na+)相同
D. 從c點到d點,溶液中![]() 保持不變(其中HA、A-分別代表相應的酸和酸根離子)
保持不變(其中HA、A-分別代表相應的酸和酸根離子)
【答案】D
【解析】
酸的電離平衡常數越大,酸的酸性越強,根據電離平衡常數知,酸性:HNO2>CH3COOH,
A. 酸或堿抑制水電離,酸中c(H+)越大其抑制水電離程度越大,酸中c(H+):b>c,則抑制水電離程度:b>c,所以水電離程度:b<c,故A錯誤;
B. 加水稀釋促進弱酸電離,pH相同的這兩種酸稀釋相同倍數,pH變化大的酸性較強,根據圖知,pH變化較大的是II,則II表示較強的酸HNO2,所以曲線I表示CH3COOH,故B錯誤;
C. a點兩種溶液的pH相同,但是兩種溶液濃度:HNO2<CH3COOH,相同體積的a點兩種溶液中溶質物質的量:HNO2<CH3COOH,消耗的堿與酸的物質的量成正比,所以消耗的堿:HNO2<CH3COOH,根據Na原子守恒知溶液中n(Na+):HNO2<CH3COOH,故C錯誤;
D. 水解平衡常數只與溫度有關,![]() =Kh,從c點到d點,溫度不變,水解平衡常數不變,所以溶液中
=Kh,從c點到d點,溫度不變,水解平衡常數不變,所以溶液中![]() 保持不變,故D正確;
保持不變,故D正確;
答案選D。


科目:高中化學 來源: 題型:
【題目】將氯化鋁溶液和氫氧化鈉溶液等體積混合,得到的沉淀物中含鋁元素的質量與溶液中含鋁元素的質量相等,則原氯化鋁溶液和氫氧化鈉溶液的物質的量濃度之比可能是
①1∶3 ②2∶3 ③1∶4 ④2∶7 ⑤任意比
A.①④B.⑤C.②③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCl晶體中Na+與Cl-都是等距離交錯排列,若食鹽的密度是2.2 g·cm-3,阿伏加德羅常數6.02×1023mol-1,食鹽的摩爾質量為58.5 g·mol-1。則食鹽晶體中兩個距離最近的鈉離子中心間的距離是多少?_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】十八大以來,各地重視“藍天保衛戰”戰略。作為煤炭使用大國,我國每年煤炭燃燒釋放出的大量SO2嚴重破壞生態環境。現階段主流煤炭脫硫技術通常采用石灰石-石膏法將硫元素以CaSO4的形式固定,從而降低SO2的排放。但是煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低脫硫效率。相關反應的熱化學方程式如下:
反應Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反應Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
請回答下列問題:
(1)反應CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;該反應在________(填“高溫”“低溫”“任意溫度”)可自發進行。
(2)恒溫密閉容器中,加入足量CaSO4和一定物質的量的CO氣體,此時壓強為p0。tmin中時反應達到平衡,此時CO和CO2體積分數相等,CO2是SO2體積分數的2倍,則反應I的平衡常數Kp=________(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p·x(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數)。
(3)圖1為1000K時,在恒容密閉容器中同時發生反應I和II,c(SO2)隨時間的變化圖像。請分析圖1曲線中c(SO2)在0~t2區間變化的原因___________________。

(4)圖2為實驗在恒容密閉容器中,測得不同溫度下,反應體系中初始濃度比![]() 與SO2體積分數的關系曲線。下列有關敘述正確的是______________________。
與SO2體積分數的關系曲線。下列有關敘述正確的是______________________。
A.當氣體的平均密度不再變化,反應I和反應Ⅱ同時達到平衡狀態
B.提高CaSO4的用量,可使反應I正向進行,SO2體積分數增大
C.其他條件不變,升高溫度,有利于反應I正向進行,SO2體積分數增大,不利于脫硫
D.向混合氣體中通入氧氣(不考慮與SO2反應),可有效降低SO2體積分數,提高脫硫效率
(5)圖1中,t2時刻將容器體積減小至原來的一半,t3時達到新的平衡,請在圖1中畫出t2-t3區間c(SO2)的變化曲線__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2S2O3應用廣泛,水處理中常用作還原劑、冶金中常用作絡合劑。
(1)Na2S2O3的實驗室制法:裝置如圖(加熱和夾持裝置略):

已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中發生反應的化學方程式為______。
②實驗過程中,乙中的澄清溶液先變渾濁,后變澄清時生成大量的Na2S2O3。一段時間后,乙中再次出現少量渾濁,此時須立刻停止通入SO2。結合離子方程式解釋此時必須立刻停止通入SO2的原因:______。

③丙中,NaOH溶液吸收的氣體可能有______。
(2)實際工業生產中制得的Na2S2O3溶液中常混有少量Na2SO3,結合溶解度曲線(如圖),獲得Na2S2O35H2O的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸鹽加熱浸金是一種環境友好的黃金(Au)浸取工藝。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在堿性較強時受熱會生成CuO沉淀。
①將金礦石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反應的原理為:
i.Cu(NH3)42+ + Au + 2S2O32![]() Cu(NH3)2+ + Au(S2O3)23+ 2NH3
Cu(NH3)2+ + Au(S2O3)23+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH
浸金過程Cu(NH3)42+起到催化劑的作用,金總反應的離子方程式為:______。

② 一定溫度下,相同時間金的浸出率隨體系pH變化曲線如如圖,解釋pH>10.5時,金的浸出率降低的可能原因_______。(寫出2點即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
研究發現,在CO2低壓合成甲醇反應(CO2+3H2=CH3OH+H2O)中,Co氧化物負載的Mn氧化物納米粒子催化劑具有高活性,顯示出良好的應用前景。回答下列問題:
(1)Co基態原子核外電子排布式為_____________。元素Mn與O中,第一電離能較大的是_________,基態原子核外未成對電子數較多的是_________________。
(2)CO2和CH3OH分子中C原子的雜化形式分別為__________和__________。
(3)在CO2低壓合成甲醇反應所涉及的4種物質中,沸點從高到低的順序為_________,原因是______________________________。
(4)硝酸錳是制備上述反應催化劑的原料,Mn(NO3)2中的化學鍵除了σ鍵外,還存在________。
(5)MgO具有NaCl型結構(如圖),其中陰離子采用面心立方最密堆積方式,X射線衍射實驗測得MgO的晶胞參數為a=0.420nm,則r(O2-)為________nm。MnO也屬于NaCl型結構,晶胞參數為a' =0.448 nm,則r(Mn2+)為________nm。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組的同學用下圖所示裝置研究有關電化學的問題(甲、乙、丙三池中溶質足量),當閉合該裝置的電鍵K時,觀察到電流計的指針發生了偏轉。請回答下列問題:

(1)甲池為______(填原電池、電解池或電鍍池),通入甲醇電極的電極反應式為________。
(2)乙池中B電極為______(填“正極”、“負極”、“陰極”或“陽極”),該池的總反應化學方程式為________。
(3)當乙池中B極質量增重5.4g時,甲池中理論上消耗O2的體積為______mL(標準狀況)。
(4)丙池中,C上的電極反應式為________________。如果起始時盛有1000 mL pH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變為1。若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入_____(填物質名稱),其質量約為_______g。
(5)若將丙池中兩個電極改成等質量的Fe和Cu,實現在Fe上鍍Cu,當甲中消耗1.6g甲醇時,丙中兩個電極質量差為______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列酸堿溶液恰好完全中和,如圖所示,則下列敘述正確的是

A.因為兩種酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,則說明HA為強酸,HB為弱酸
C.若實驗①中,V=V1,則混合液中c(Na+)=c(A-)
D.實驗②的混合溶液,可能溶液呈酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組利用芳香族化合物A制取有機物F的合成路線如下:

已知:![]()
回答下列問題:
(1)A的分子式為_____________;B→C的反應類型為____________。
(2)足量的D與Na2CO3溶液發生反應的化學方程式:_______________________________。
(3)E的結構簡式為______________。
(4)碳原子上連有4個不同的原子或基團時,該碳原子稱為手性碳。寫出上述合成路線中含有手性碳的物質結構簡式并用星號(*)標出手性碳:______________。
(5)芳香族化合物M與A互為同分異構體,且M能發生銀鏡反應,則M的結構有________種(不考慮立體異構);其中核磁共振氫譜顯示有4種不同化學環境的氫且峰面積之比為6:2:1:1的結構簡式有____________________________________________________(任寫一種)。
(6)結合已知信息寫出用1-溴丙烷和苯為原料制備![]() 的合成路線(其他試劑任選)。
的合成路線(其他試劑任選)。
_________________________________________________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com