
【題目】[選修3:物質結構與性質](20分)
Ⅰ(6分)下列敘述正確的有
A.某元素原子核外電子總數是最外層電子數的5倍,則其最高正價為+7
B.鈉元素的第一、第二電離能分別小于鎂元素的第一、第二電離能
C.高氯酸的酸性與氧化性均大于次氯酸的酸性和氧化性
D.鄰羥基苯甲醛的熔點低于對羥基苯甲醛的熔點
Ⅱ(14分)ⅣA族元素及其化合物在材料等方面有重要用途。回答下列問題:
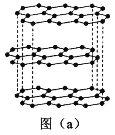
(1)碳的一種單質的結構如圖(a)所示。該單質的晶體類型為___________,原子間存在的共價鍵類型有________,碳原子的雜化軌道類型為__________________。


(2)SiCl4分子的中心原子的價層電子對數為__________,分子的立體構型為________,屬于________分子(填“極性”或“非極性”)。
(3)四鹵化硅SiX4的沸點和二鹵化鉛PbX2的熔點如圖(b)所示。
①SiX4的沸點依F、Cl、Br、I次序升高的原因是_________________。
②結合SiX4的沸點和PbX2的熔點的變化規律,可推斷:依F、Cl、Br、I次序,PbX2中的化學鍵的離子性_______、共價性_________。(填“增強”“不變”或“減弱”)
(4)碳的另一種單質C60可以與鉀形成低溫超導化合物,晶體結構如圖(c)所示。K位于立方體的棱上和立方體的內部,此化合物的化學式為_______________;其晶胞參數為1.4 nm,晶體密度為_______g·cm-3。
【答案】I.AD;II.(1)混合型晶體,σ鍵、π鍵;sp2;(2)4,正四面體,非極性;(3)①均為分子晶體,范德華力隨分子相對質量增大而增大;②減弱,增強;(4)K3C60,2.0。
【解析】I.A、某元素原子核外電子總數是最外層電子數的5倍,此元素是Br,位于VIIA族,最高正價為+7價,故A正確;B、金屬鈉比鎂活潑,容易失去電子,因此鈉的第一電離能小于Mg的第一電離能,Na最外層只有一個電子,再失去一個電子,出現能層的變化,需要的能量增大,Mg最外層有2個電子,因此Na的第二電離能大于Mg的第二電離能,故B錯誤;C、HClO4可以寫成(HO)ClO3,HClO寫成(HO)Cl,高氯酸的中非羥基氧多于次氯酸,因此高氯酸的酸性強于次氯酸,但高氯酸的氧化性弱于次氯酸,故C錯誤;D、鄰羥基苯甲醛形成分子內氫鍵,降低物質熔點,對羥基苯甲醛形成分子間氫鍵,增大物質熔點,因此鄰羥基苯甲醛的熔點低于對羥基苯甲醛的熔點,故D正確;II.(1)該單質為石墨,石墨屬于混合型晶體,層內碳原子之間形成σ鍵,層間的碳原子間形成的是π鍵;石墨中碳原子有3個σ鍵,無孤電子對,因此雜化類型為sp2;(2)SiCl4中心原子是Si,有4個σ鍵,孤電子對數為(4-4×1)/2=0,價層電子對數為4,空間構型為正四面體;屬于非極性分子;(3)①SiX4屬于分子晶體,不含分子間氫鍵,范德華力越大,熔沸點越高,范德華力隨著相對質量的增大而增大,即熔沸點增高;②同主族從上到下非金屬性減弱,得電子能力減弱,因此PbX2中化學鍵的離子型減弱,共價型增強;(4)根據晶胞的結構,C60位于頂點和面心,個數為8×1/8+6×1/2=4,K為與棱上和內部,個數為12×1/4+9=12,因此化學式為K3C60,晶胞的質量為![]() g,晶胞的體積為(1.4×10-7)3cm3,根據密度的定義,則晶胞的密度為2.0g/cm3。
g,晶胞的體積為(1.4×10-7)3cm3,根據密度的定義,則晶胞的密度為2.0g/cm3。


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源: 題型:
【題目】將一小塊鈉投入到滴有石蕊的水中,下列有關現象的敘述錯誤的是( )
A.鈉浮在液面上 B.有無色無味的氣體產生
C.水溶液變為藍色 D.水溶液變為紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組的同學欲對一粗鹽樣品進行初步提純。所用實驗儀器或用品如下:

(1)D的名稱是_______;
(2)提純的步驟是:溶解、過濾、_______、計算產率;
(3)“過濾”操作的要點可概括為“一貼、二低、三靠”,其中“二低”的含義是__________________________;
(4)實驗小組通過正確的計算發現,所得實驗結果與該粗鹽的實際含量對比,實驗測得的結果比實際偏低,請分析可能的原因:_________________________________。
(5)如何用密度為1.84 g·cm-3、質量分數為98%的濃硫酸來配制0.5 mol·L-1的H2SO4溶液500 mL?簡述配制過程_______________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題:

(1)從氯化鉀溶液中得到氯化鉀固體,選擇裝置________(填代表裝置圖的字母,下同);除去自來水中的Cl-等雜質,選擇裝置________。
(2)從油水混合物中分離出植物油,選擇裝置________,該分離方法的名稱為________。
(3)裝置A中①的名稱是________,進水的方向是從________口進水。裝置B在分液時為使液體順利滴下,除打開活塞外,還應進行的具體操作是______________________。
(4)海水中蘊藏著豐富的資源,在實驗室中取少量海水,進行如下流程的實驗:
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
粗鹽中含Ca2+、Mg2+、Fe3+、SO![]() 等雜質,需要提純后才能綜合利用。粗鹽提純的步驟有:
等雜質,需要提純后才能綜合利用。粗鹽提純的步驟有:
①加入過量的Na2CO3溶液 ②加入過量的BaCl2溶液 ③加入過量的NaOH溶液 ④調節溶液的pH等于7 ⑤溶解 ⑥過濾 ⑦蒸發
正確的操作順序是________(填選項字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核安全與放射性污染防治已引起世界核大國的廣泛重視。在爆炸的核電站周圍含有放射性物質碘一131和銫一 137。碘—131—旦被人體吸入,可能會引發甲狀腺等疾病。
(l)Cs(銫)的價電子的電子排布式為6s1,與銫同主族的前四周期(包括第四周期)的三種金屬元素X、Y、Z的電離能如下表
元素代號 | X | Y | Z |
第一電離能(kJ·mol-1) | 520 | 496 | 419 |
上述三種元素X、Y、Z的元素符號分別為_________,基態Z原子的核外電子排布式為______,X形成的單質晶體中含有的化學鍵類型是_________________。
(2)F與I同主族,BeF2與H2O都是由三個原子構成的共價化合物分子,二者分子中的中心原子Be和O的雜化方式分別為______、______,BeF2分子的立體構型是____________,H2O分子的立體構型是________________。
(3)與碘同主族的氯具有很強的活潑性,能形成大量的含氯化合物。BC13分子中B—C1鍵的鍵角為__________________。
(4) 131I2晶體的晶胞結構如圖甲所示,該晶胞中含有____個131I2分子;KI的晶胞結構如圖乙所示,每個K+緊鄰______個I-。

(5)KI晶體的密度為ρg cm 3,K和I的摩爾質量分別為MK g mol-1和MIg mol-1,原子半徑分別為rKpm和rI pm,阿伏加德羅常數值為NA,則KI晶胞中原子的體積占晶胞體積的百分率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是幾種原子的基態電子排布,電負性最大的原子是( )
A. 1s22s22p4 B. 1s22s22p63s23p3
C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質用途的說法中,不正確的是( )
A. 干冰可用作致冷劑 B. 在鐵制容器表面刷鋁粉可防止生銹
C. 氫氧化鈉可用作醫用胃酸中和劑 D. 過氧化鈉可用作供氧劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com