
【題目】實驗室利用如圖裝置進行中和熱的測定,請回答下列問題:

(1)做1次完整的中和熱測定實驗,溫度計至少需使用________次,某同學為了省去清洗溫度計的麻煩,建議實驗時使用兩支溫度計分別測量酸和堿的溫度,你是否同意該同學的觀點,為什么?_______________。
(2)實驗室用50 mL 0.50 mol·L-1鹽酸,50 mL 0.55 mol·L-1 NaOH溶液進行測定中和熱的實驗,為了把測量數據記錄下來,請你設計表格__________。
【答案】3不同意,因為不同的溫度計誤差不同
溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差(t2-t1)/℃ | ||
鹽酸 | NaOH溶液 | 平均值 | |||
1 | |||||
2 | |||||
3 | |||||
【解析】
(1)溫度計要測反應前酸溶液的溫度,測反應前堿溶液的溫度,混合反應后測最高溫度,因此一共3次;由于不同溫度計的誤差不同,所以實驗時不能使用兩支溫度計分別測量酸和堿的溫度;
(2)中和熱的實驗原理:溫度計要測反應前酸溶液的溫度,測反應前堿溶液的溫度,求出兩者的平均值,混合反應后測最高溫度一共3次,最后求出溫度差,為了減少誤差應重復2-3次,所以表格為:
溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差(t2-t1)/℃ | ||
鹽酸 | NaOH溶液 | 平均值 | |||
1 | |||||
2 | |||||
3 | |||||
。


科目:高中化學 來源: 題型:
【題目】下列實驗操作和實驗結論均正確的是
實驗操作 | 實驗結論 | |
A | 先加少量氯水,再滴加KSCN溶液,出現血紅色 | 證明某溶液中存在Fe2+ |
B | 向AgCl懸濁液中加入NaI溶液時出現黃色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸鈣中滴加鹽酸,有氣泡產生 | 證明氯的非金屬性大于碳 |
D | 將MgCl2溶液在氯化氫的氣流中蒸發、結晶、過濾 | 制備氯化鎂晶體 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于元素周期表的敘述中正確的是( )
A. 在金屬元素與非金屬元素的分界線附近可以尋找制備半導體材料元素
B. 在過渡元素中可以尋找制備催化劑
C. 在元素周期表的右上角可以尋找制備耐高溫和耐腐蝕的元素
D. 在地球上元素的分布和它們在元素周期表中的位置有密切關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N0表示阿伏加德羅常數的值,下列說法正確的是
A. 1g H2所含分子數為N0
B. 2g D2O中所含的質子數為N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 數為N0
D. 標準狀況下,4.48 L CCl4所含原子數為N0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作和實驗結論均正確的是
實驗操作 | 實驗結論 | |
A | 先加少量氯水,再滴加KSCN溶液,出現血紅色 | 證明某溶液中存在Fe2+ |
B | 向AgCl懸濁液中加入NaI溶液時出現黃色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸鈣中滴加鹽酸,有氣泡產生 | 證明氯的非金屬性大于碳 |
D | 將MgCl2溶液在氯化氫的氣流中蒸發、結晶、過濾 | 制備氯化鎂晶體 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“氫能”是未來最理想的新能源。
(1)實驗測得,1 g氫氣燃燒生成液態水時放出142.9 kJ熱量,則氫氣燃燒的熱化學方程式為_____。(填序號)
A.2H2(g)+O2(g)=2H2O(l) ΔH =-142.9 kJ·mol1
B.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol1
C.2H2+O2=2H2O(l) ΔH= 571.6 kJ·mol1
D.H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol1
(2)某化學家根據“原子經濟”的思想,設計了如下制備H2的反應步驟:
① CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
② 2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③ HgBr2+_______![]() ________
________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2+O2![]() 2H2O
2H2O
請你根據“原子經濟”的思想完成上述步驟③的化學方程式:___________。并根據“綠色化學”的思想評估該方法制H2的主要缺點_________。
(3)利用核能把水分解制氫氣,是目前正在研究的課題。如圖是其中的一種流程,其中用了過量的碘。
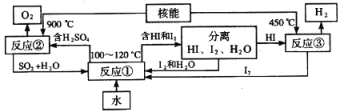
完成下列反應的化學方程式:反應①______________;反應②____________。此法制取氫氣的最大優點是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】城市使用的燃料,現大多用煤氣、液化石油氣。煤氣的主要成分是一氧化碳和氫氣的混合氣,它由煤炭與水(蒸氣)反應制得,故又稱水煤氣。
(1)試寫出制取水煤氣的主要化學方程式___________________。
(2)液化石油氣的主要成分是丙烷,丙烷燃燒的熱化學方程式為:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220.0 kJmol1。已知CO氣體燃燒的熱化學方程式為:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJmol1。試比較相同物質的量的C3H8和CO燃燒,產生的熱量比值約為_________。
(3)已知氫氣燃燒的熱化學方程式為:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol1。試比較同質量的氫氣和丙烷燃燒,產生的熱量比值約為______。
(4)氫氣是未來的能源,除產生的熱量大之外,還具有的優點是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:HCN(aq)與NaOH(aq)反應的ΔH=-12.1 kJ·mol-1;HCl(aq)與NaOH(aq)反應的ΔH=-55.6 kJ·mol-1,則HCN在水溶液中電離的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。下列有關說法正確的是

A. a、b、c、d、e中,c最穩定
B. b→a+c反應的活化能為反應物能量減生成物能量
C. b→a+d反應的熱化學方程式為:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定溫度下,Cl2與NaOH溶液反應生成的產物有a、b、d,溶液中a、b、d的濃度之比可能為11∶1∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com