
【題目】把過量鐵屑加入FeCl3、CuCl2的混合溶液中,反應結束后,稱得剩余固體的質量與所加鐵屑的質量相等。則原溶液中FeCl3與CuCl2的物質的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根據反應①2Fe3++Fe=3Fe2+可知,鐵溶解,固體質量減少,根據反應②Cu2++Fe=Cu+Fe2+可知,鐵溶解,銅析出,固體質量增加,而反應結束后,稱得剩余固體質量與所加鐵屑的質量相等,則反應①中固體減少的質量與反應②中固體增加的質量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案為D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案為D。
【點睛】
考查Fe3+、Cu2+的氧化能力大小的比較,能正確判斷固體的成分是解本題的關鍵;根據Fe3+、Cu2+的氧化性強弱判斷反應先后順序,從而確定固體的成分、溶液的成分;有固體剩余,若固體只有銅,則反應后的溶液中一定無Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有鐵剩余,一定有銅生成,Fe3+和Cu2+無剩余。
【題型】單選題
【結束】
7
【題目】下列說法正確的是( )
A.綠礬是含有一定量結晶水的硫酸亞鐵,在試管中加入少量綠礬樣品,加水溶解,滴加KSCN溶液,溶液顏色無明顯變化。再向試管中通入空氣,溶液逐漸變紅。由此可知:樣品中沒有Fe3+,Fe2+易被空氣氧化為Fe3+
B.在給定條件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以實現
Fe(OH)2可以實現
C.Fe與Cl2反應生成FeCl3,推測Fe與I2反應生成FeI3
D.鐵比銅金屬性強,故用FeCl3溶液腐蝕印刷電路板上的銅
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A.用石墨作電極電解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.過量的鐵粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀鹽酸,CO2的生成量與加入鹽酸的體積的關系如圖。下列判斷正確的是( )
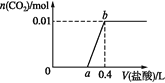
A.在0~a范圍內,只發生H++OH-=H2O
B.ab段發生反應的離子方程式為:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH與Na2CO3的物質的量之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學小組設計以下實驗方案,測定某部分變質為碳酸鈉的小蘇打樣品中NaHCO3的質量分數。
(1)方案一:稱取一定質量樣品,置于儀器a中用酒精燈加熱至恒重,冷卻,用托盤天平稱量剩余固體質量。重復操作,計算。儀器a的名稱是____________。
(2)方案二:稱取此混合物9.5g,溶于水中,配成100 mL溶液。利用化學反應把HCO3—、CO32—完全轉化為沉淀,稱量干燥沉淀的質量,由此計算混合物中ω(NaHCO3)。
①取配制好的溶液于燒杯中,滴加足量沉淀劑,把溶液中HCO3—、CO32—完全轉化為沉淀,應選用的試劑
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②過濾,提取沉淀,則過濾操作所需要的玻璃儀器除玻璃棒、燒杯外,還有____________。
③將沉淀洗滌,并充分干燥,稱量沉淀的質量為19.7g。由此可以計算ω(NaHCO3)= ____________。
(3)方案三:稱取一定質量樣品,按如圖裝置進行實驗:
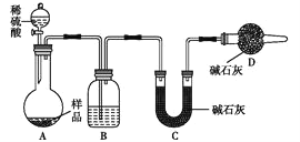
①B裝置內所盛試劑是____________;
②D裝置的作用是________。
③某同學認為上述測定結果__________(填“偏高”或“偏低”),因為實驗裝置還存在一個明顯的缺陷是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子組在指定溶液中能大量共存的是
A. 常溫下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚顯紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常溫下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,將1.0Lwmol·L-1CH3COOH溶液與0.1molNaOH固體混合,充分反應。然后向混合液中加入CH3COOH或CH3COONa固體(忽略體積和溫度變化),溶液pH的變化如圖所示。下列敘述正確的是( )
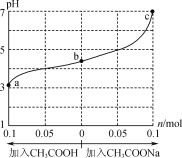
A.b點溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b點到a點的過程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c對應的混合液中,水的電離程度由大到小的順序是c>a>b
D.25℃時,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黃色變為淺綠色,但立即又變為棕黃色,這時若滴入BaCl2溶液,會產生白色沉淀。針對上述一系列變化過程,下列說法不正確的是( )
A.上述過程中,最終被還原的是NO3-
B.從上述過程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述過程中,會產生一種無色的難溶于水的氣體
D.若通入的SO2完全反應,則同溫同壓下,SO2和逸出氣體的體積比為3∶2
【答案】B
【解析】
A.SO2通入硝酸鐵稀溶液中,溶液由棕黃色變為淺綠色,是因為Fe3+與SO2發生氧化還原反應生成SO42-、Fe2+;溶液立即又變為棕黃色,是因為Fe2+與NO3-、H+發生氧化還原反應生成Fe3+,所以最終被還原的是NO3-,故A正確;
B.SO2能夠被Fe3+氧化成H2SO4,Fe2+能夠被稀硝酸氧化成Fe3+,則氧化性:稀硝酸>Fe3+>稀硫酸,故B錯誤;
C.稀溶液中,NO3-在酸性環境中被還原為NO,NO是無色的難溶于水的氣體,故C正確;
D.上述過程中,最終被還原的是NO3-,故整個過程相當于SO2和NO3-之間發生了氧化還原反應,由關系式3SO2~2NO3-可知,SO2與NO的體積比為3∶2,故D正確;
故答案為B。
【題型】單選題
【結束】
14
【題目】某廢水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小組欲測定其中SO32-的濃度,設計如圖所示的實驗方案:
![]()
則試劑X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019 年 9 月,我國科研人員研制出 Ti-H-Fe 雙溫區催化劑,其中 Ti-H 區域和Fe 區域的溫度差可超過100℃。Ti-H-Fe雙溫區催化合成氨的反應歷程如圖所示,其中吸附在催化劑表面上的物種用*標注。下列說法錯誤的是
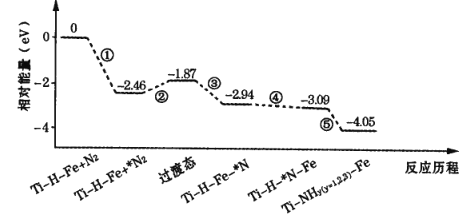
A.①②③在 Fe 區域發生,④⑤在Ti-H區域發生
B.在高溫區加快了反應速率,低溫區提高了氨的產率
C.該歷程中能量變化最大的是2. 46eV,是氮分子中氮氮三鍵的斷裂過程
D.使用 Ti-H-Fe 雙溫區催化合成氨,不會改變合成氨反應的反應熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得出的結論正確的是
選項 | 實驗操作和現象 | 結論 |
A | 向BaCl2溶液中通入SO2和氣體X,出現白色沉淀 | 氣體X一定作氧化劑 |
B | NaHCO3溶液與NaAlO2溶液混合,立即產生白色沉淀 | 結合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的試管中加入足量稀硫酸,溶液變為藍色,試管底有紅色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的試管中分別滴入2滴0.1mol/LAlCl3、MgCl2溶液,振蕩,前者無沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com