
某化學興趣小組在家中進行化學實驗,按照圖甲連接好線路發現燈泡不亮,按照圖乙連接好線路發現燈泡亮,由此得出的結論正確的是( )
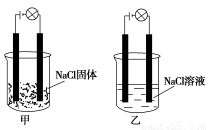
A.NaCl是非電解質
B.NaCl溶液是電解質
C.NaCl是弱電解質
D.NaCl在水溶液中電離出了可以自由移動的離子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練9-2練習卷(解析版) 題型:選擇題
用鉑電極電解一定濃度的下列物質的水溶液,在電解后的電解液中加適量水,能使溶液濃度恢復到電解前濃度的是( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練8-3練習卷(解析版) 題型:選擇題
下列溶液在空氣中加熱、蒸干、灼燒后,所得固體為原溶液中的溶質的是( )
A.NaHCO3 B.KMnO4 C.FeCl3 D.NaCl
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練8-1練習卷(解析版) 題型:填空題
煉金廢水中含有絡離子[Au(CN)2]-,其電離出的CN-有毒,當CN-與H+結合生成HCN時,毒性更強。回答下列問題。
(1)劇毒物HCN的水溶液酸性很弱,寫出其電離的方程式: 。
(2)與弱電解質碳酸的電離方式相似,[Au(CN)2]-也存在著兩步電離,其一級電離方程式為 。
(3)處理這種廢水是在堿性條件下,利用NaClO將CN-氧化為CO32-和N2,其離子方程式為 。在酸性條件下,ClO-也能氧化CN-,但實際處理廢水時卻不在酸性條件下進行的主要原因是 。
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練8-1練習卷(解析版) 題型:選擇題
下面是有關弱酸的電離平衡常數。
弱酸化學式 | CH3COOH | HCN | H2CO3 |
電離平衡常數 (25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
結合數據,分析下列有關說法,其中錯誤的是( )
A.1 mol·L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.升高溫度,HCN溶液中H+濃度增大,平衡正向移動,電離平衡常數增大
C.向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的電離平衡都正向移動
D.向CH3COOH溶液中加入少量氫氧化鈉固體,平衡正向移動
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練7-3練習卷(解析版) 題型:填空題
二氧化碳捕集、存儲和轉化是當今化學研究的熱點問題之一。
(1)用釕的配合物作催化劑,一定條件下可直接光催化分解CO2,發生反應:2CO2(g)=2CO(g)+O2(g),該反應的ΔH 0,ΔS 0(選填“>”、“<”或“=”),在低溫下,該反應 (填“能”或“不能”)自發進行。
(2)CO2轉化途徑之一是利用太陽能或生物質能分解水制H2,然后將H2與CO2轉化為甲醇或其他化學品。你認為該方法需要解決的技術問題有 。
a.開發高效光催化劑
b.將光催化制取的氫氣從反應體系中有效分離,并與CO2發生催化轉化
c.二氧化碳及水資源的供應
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練7-3練習卷(解析版) 題型:選擇題
在某溫度下,將2 mol A和3 mol B充入一密閉容器中,發生反應:aA(g)+B(g)  C(g)+D(g),5 min后達平衡,已知各物質的平衡濃度的關系為ca(A)·c(B)=c(C)·c(D)。若在溫度不變的情況下,將容器的體積擴大為原來的10倍,A的轉化率沒有發生變化,則B的轉化率為( )
C(g)+D(g),5 min后達平衡,已知各物質的平衡濃度的關系為ca(A)·c(B)=c(C)·c(D)。若在溫度不變的情況下,將容器的體積擴大為原來的10倍,A的轉化率沒有發生變化,則B的轉化率為( )
A.60% B.40% C.24% D.4%
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練7-2練習卷(解析版) 題型:選擇題
在水溶液中存在反應:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,達到平衡后,為使平衡體系中析出更多的銀,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,達到平衡后,為使平衡體系中析出更多的銀,可采取的措施是( )
A.升高溫度 B.加水稀釋
C.增大Fe2+的濃度 D.常溫下加壓
查看答案和解析>>
科目:高中化學 來源:2014年高考化學一輪復習課后規范訓練5-3練習卷(解析版) 題型:選擇題
據新浪科技網報道:美國科學家發現,普通鹽水在無線電波的照射下可以燃燒,這很可
能是21世紀人類最偉大的發現之一,將有望解決未來人類的能源危機。無線電頻率可以降低鹽水中所含元素之間的結合力,釋放出氫原子,一旦點火,氫原子就會在這種頻率下持續燃燒。上述“結合力”的實質是( )
A.離子鍵 B.共價鍵 C.一種靜電引力 D.一種靜電斥力
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com