
【題目】雙氧水(過氧化氫)常用于消毒、殺菌、漂白等。某化學興趣小組同學,圍繞著過氧化氫開展了調査研究與實驗。
I.調查
(1)過氧化氫常用于消毒、殺菌、漂白等方面的主要原因是________。
(2)制備過氧化氫目前最常用的是乙基蒽醌法,其主要過程可以用如圖表示,此過程中總反應式為________。

Ⅱ.不穩定性實驗研究
(3)為了探究溫度、催化劑等外界條件對 H2O2的分解速率的影響,某興趣小組同學設計了如下三組實驗,部分實驗數據已經填在下面表中。
實驗編號 | T/X | H2O2初始濃度/mol·L-1 | FeCl3初始濃度/mol·L-1 |
I | 20 | 1.0 | _______ |
II | 50 | 1.0 | 0 |
III | 50 | ___________ | 0.1 |
實驗I、Ⅱ研究______對分解速率的影響,實驗Ⅱ、Ⅲ研究催化劑對分解速率的影響,則實驗Ⅲ中H2O2初始濃度應為________mol·L-1。
III.過氧化氫含量的實驗測定
興趣小組同學用0.1000mol·L-1酸性高錳酸鉀標準溶液滴定試樣中過氧化氫的含量,反應原理為2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑
(4)用移液管吸取25.00mL試樣置于錐形瓶中,重復滴定四次,每次消耗的KMnO4標準溶液體積如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
計算試樣中過氧化氫的濃度為________mol·L-1(保留三位有效數字)。
【答案】過氧化氫具有強氧化性 H2+O2![]() H2O2 溫度 1.0 0.180
H2O2 溫度 1.0 0.180
【解析】
(1)過氧化氫具有強氧化性;
(2)乙基蒽醌作催化劑,氫氣和氧氣反應生成雙氧水;;
(3)①實驗Ⅰ、Ⅱ,只有溫度不同;實驗Ⅱ、Ⅲ研究催化劑對分解速率的影響,則濃度相同;
②先比較溫度,溫度低的反應速率慢;
(4)由表中數據可知,第一次誤差大可舍棄,其它三次的平均體積為18.00mL,結合反應計算。
(1)過氧化氫常用于消毒、殺菌、漂白等利用了過氧化氫的性質是強氧化性;
(2)通過圖示可知,用乙基蒽醌作催化劑制取雙氧水,反應為:H2+O2![]() H2O2;
H2O2;
(3)實驗Ⅰ、Ⅱ研究溫度對分解速率的影響,實驗Ⅱ、Ⅲ是研究催化劑對分解速率的影響,物質的濃度相同,則實驗Ⅲ中H2O2初始濃度應為1.0moL/L;
(4)由表中數據可知,第一次誤差大可舍棄,其它三次的平均體積為18.00mL,由2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑可知,過氧化氫的濃度c(H2O2)=![]() c(MnO4-)=
c(MnO4-)=![]() ×
×![]() =0.180mol/L。
=0.180mol/L。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(NH4)2SO3氧化是氨法脫硫的重要過程。某小組在其他條件不變時,分別研究了一段時間內溫度和(NH4)2SO3初始濃度對空氣氧化(NH4)2SO3速率的影響,結果如圖。下列說法不正確的是
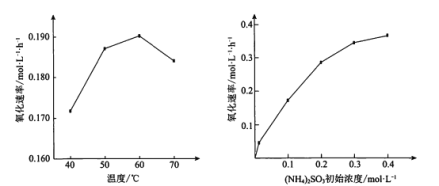
A.60℃之前,氧化速率增大與溫度升高化學反應速率加快有關
B.60℃之后,氧化速率降低可能與O2的溶解度下降及(NH4)2SO3受熱易分解有關
C.(NH4)2SO3初始濃度增大到一定程度,氧化速率變化不大,與SO32-水解程度增大有關
D.(NH4)2SO3初始濃度增大到一定程度,氧化速率變化不大,可能與O2的溶解速率有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,某同學設計一個甲醚(CH3OCH3)燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。

(1)寫出負極的電極反應式________________________ 。
(2)石墨電極(C)的電極反應式為___________________。
(3)反應一段時間后,乙裝置中生成NaOH主要在 __________(填“鐵極”或“石墨極”)區。
(4)如果粗銅中含有鋅、銀等雜質,丙裝置中鋅先于金屬銅放電進入溶液,反應一段時間,硫酸銅溶液濃度將_________ (填“增大”、“減小”或“不變”)
(5)若在標準狀況下,有2.24L氧氣參加反應,則在乙裝置中鐵電極上生成的氣體在標準狀況下的體積為__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是CO2催化還原為CH4示意圖。下列說法不正確的是( )
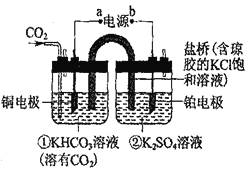
A.該過程是電能轉化為化學能的過程
B.銅電極的電極反應式為CO2+8H++8e-=CH4+2H2O
C.一段時間后,①池中n(KHCO3)不變
D.一段時間后,②池中溶液的pH一定下降
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃,c(HCN)+c(CN-)=0.1 mol·L-1的一組HCN和NaCN的混合溶液,溶液中 c(HCN)、c(CN-)與pH的關系如圖所示。下列有關離子濃度關系敘述正確的是( )
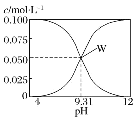
A.將 0.1 mol·L-1 的 HCN 溶液和 0.1 mol·L-1NaCN溶液等體積混合(忽略溶液體積變化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+)
B.W 點表示溶液中:c(Na+)=c(HCN)+c(CN-)
C.pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1 mol·L-1+c(OH-)
D.將0.3 mol·L-1 HCN溶液和0.2 mol·L-1NaOH溶液等體積混合(忽略溶液體積變化):c(CN-)+3c(OH-)=c(HCN)+3c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(I)下表是25℃時某些弱酸的電離平衡常數。
化學式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4與含等物質的量的KOH的溶液反應后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物質的量濃度的大小關系是(填“>”、“<”或“=”):CH3COOK_____NaClO,兩溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸鈉溶液中滴加少量氯水的離子方程式為__________。
(II)H3PO2也可用電滲析法制備。“四室電滲析法”工作原理如圖所示(陽膜和陰膜分別只允許陽離子、陰離子通過):

(4)寫出陽極的電極反應式_________。
(5)分析產品室可得到H3PO2的原因___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知AgCl的Ksp=1.8×10-10。常溫下在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL0.01 mol·L-1 AgNO3溶液,下列說法正確的是 ( )
A.有AgCl沉淀析出B.無AgCl沉淀析出
C.無法確定D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】炭黑是霧霾中的重要顆粒物,研究發現它可以活化氧分子,生成活化氧,活化過程的能量變化模擬計算結果如圖所示,活化氧可以快速氧化二氧化硫。下列說法錯誤的是
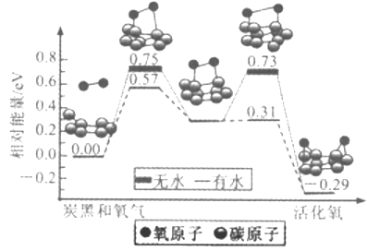
A. 氧分子的活化包括O-O鍵的斷裂與C-O鍵的生成
B. 每活化一個氧分子放出0.29eV的能量
C. 水可使氧分子活化反應的活化能降低0.42eV
D. 炭黑顆粒是大氣中二氧化硫轉化為三氧化硫的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】50mL0.50mol·L﹣1鹽酸與50mL0.55molL﹣1NaOH溶液在圖示的裝置中進行中和反應。通過測定反應過程中的熱量可計算中和熱。回答下列問題:

(1)實驗中改用60mL0.50mol·L﹣1鹽酸跟50mL0.55molL﹣1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量___(填“相等”或“不相等”),所求中和熱___(填“相等”或“不相等”),簡述理由:___。
(2)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會___;用50mL0.50mol·L﹣1CH3COOH溶液(已知CH3COOH電離時吸熱)進行上述實驗,測得的中和熱的數值會___。(均填“偏大”、“偏小”或“無影響”)
(3)平行地做一次這樣的實驗需要測定___次溫度。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com