
【題目】如圖分別表示紅磷、白磷燃燒時的能量變化,有關說法正確的是( )
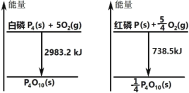
A.白磷比紅磷穩定
B.白磷燃燒產物比紅磷燃燒產物穩定
C.1mol 白磷轉變為紅磷放出 2244.7kJ 的熱量
D.紅磷燃燒的熱化學方程式:4P(s)+5O2(g)→P4O10(s)+2954kJ
【答案】D
【解析】
從圖中可以采集以下信息:P4(s)(白磷)+5O2(g)→P4O10(s)+2983.2kJ,P(s)(紅磷)+![]() O2(g)→
O2(g)→![]() P4O10(s)+738.5kJ。
P4O10(s)+738.5kJ。
A.P4(s)(白磷)+5O2(g)→P4O10(s)+2983.2kJ,則![]() P4(s)(白磷)+
P4(s)(白磷)+![]() O2(g)→
O2(g)→![]() P4O10(s)+745.8kJ,相同質量的白磷燃燒放熱多,則紅磷比白磷穩定,A錯誤;
P4O10(s)+745.8kJ,相同質量的白磷燃燒放熱多,則紅磷比白磷穩定,A錯誤;
B.白磷和紅磷的燃燒產物都為P4O10(s),產物的穩定性相同,B錯誤;
C.利用蓋斯定律,可得P4(s)(白磷) →4P(s)(紅磷)+29.2kJ,C錯誤;
D.紅磷燃燒的熱化學方程式:P(s)(紅磷)+![]() O2(g)→
O2(g)→![]() P4O10(s)+738.5kJ ,則4P(s)+5O2(g)→P4O10(s)+2954kJ,D正確;
P4O10(s)+738.5kJ ,則4P(s)+5O2(g)→P4O10(s)+2954kJ,D正確;
故選D。


科目:高中化學 來源: 題型:
【題目】某溫度下,在固定容積的容器中,可逆反應A(g)+3B(g) ![]() 2C(g)達到平衡,此時測得n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向該容器中再充入A、B和C,下列敘述正確的是
2C(g)達到平衡,此時測得n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向該容器中再充入A、B和C,下列敘述正確的是
A. 剛充入時反應速率υ正減少,υ逆增大 B. 平衡不發生移動
C. 平衡向正反應方向移動,A的物質的量濃度減小 D. 物質C的質量分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、U、W 是原子序數依次增大的前四周期元素。其中 Y 的原子核外有 7 種運動狀態不同的 電子;X、Z 中未成對電子數均為 2;U 是第三周期元素形成的簡單離子中半徑最小的元素;W 的內層電 子全充滿,最外層只有 1 個電子。請回答下列問題:
(1)U 在周期表中的位置 。X、Y、Z 的第一電離能從大到小的順序是 (用元素符號表示,下同)。
(2)寫出 W 的價電子排布圖 。
(3)根據等電子體原理,可知化合物 XZ 的電子式是 。
(4)X、Y、Z的最簡單氫化物的鍵角從大到小的順序是 ( 用化學式表示), 原因 是 。
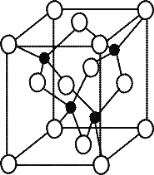
(5)由元素 Y 與 U 元素組成的化合物 A,晶胞結構如右圖所示(黑球表示 Y 原子, 白球表示 U 原子),請寫出化合物 A 的化學式 ,其中 Y 元素的雜化方式是 。
(6)U 的晶體屬立方晶系,其晶胞邊長為 405 pm,密度是 2.70 g/cm,通過計算確定 其晶胞的類型 (填簡單立方堆積、體心立方堆積或面心立方最密堆 積)(已知:4053≈6.64×107)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將氯氣持續通入紫色石蕊試液中,溶液顏色呈現如下變化:
![]()
關于溶液中導致變色的微粒Ⅰ、Ⅱ、Ⅲ的判斷正確的是( )
A.H+、ClO-、Cl2B.H+、ClO-、Cl-C.HCl、ClO-、Cl-D.H+、HClO、Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室從含碘廢液(含有I2、I-等)中回收碘,其實驗過程如下:
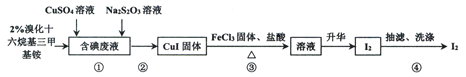
已知:溴化十六烷基三甲基銨是一種陽離子表面活性劑,可以中和沉淀表面所帶的負電荷,使沉淀顆粒快速聚集,快速下沉。下列說法不正確的是
A.步驟①中Na2S2O3可用Na2SO3代替
B.步驟②可以用傾析法除去上層清液
C.含碘廢液中是否含有IO3-,可用KI-淀粉試紙檢驗
D.步驟③發生反應的離子方程式為:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在酸性條件下,黃鐵礦( FeS2)催化氧化的反應方程式為2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,實現該反應的物質間轉化如圖所示。下列分析錯誤的是
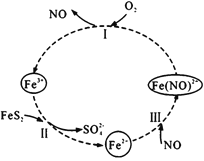
A.反應I的離子方程式為4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反應Ⅱ的氧化劑是Fe3+
C.反應Ш是氧化還原反應
D.黃鐵礦催化氧化中NO作催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組欲用下列裝置制備氯水并探究其性質。完成下列填空:
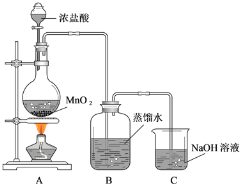
(1)C 裝置的作用是________________。
(2)氯水制備完成后,甲同學從B中取出一定量的樣品置于日光下照射一段時間,發現樣品某些性質發生了明顯的變化,請各列舉一項:
物理性質變化:________________;
化學性質變化:________________。
(3)為證明氯氣與水反應產物具有漂白性,丁同學將A中產生的氣體緩緩通過下列裝置:

試劑 a 應選擇_____; 試劑 b 應選擇_____。
(4)戊同學從B中取出少量樣品,滴到 NaHCO3 粉末上,有無色氣泡產生,由此他認為氯氣與水反應至少產生一種酸性強于碳酸的物質。請評價他的觀點是否正確并說明理由 ________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2O2可用作漂白劑和呼吸面具中的供氧劑。
(1)某學習小組發現:在盛有Na2O2的試管中加入足量水,固體完全溶解,并立即產生大量氣泡,當氣泡消失后,向其中滴入1~2滴酚酞溶液,溶液變紅;將試管輕輕振蕩,紅色很快褪去;此時再向試管中加入少量MnO2粉末,又有氣泡產生。
①使酚酞溶液變紅是因為__________,紅色褪去的可能原因是__________________。
②加入MnO2反應的化學方程式為________________________________。
(2)Na2O2有強氧化性,H2具有還原性,有同學猜想Na2O2與H2能反應。為了驗證此猜想,該小組同學進行如下實驗,實驗步驟和現象如下。
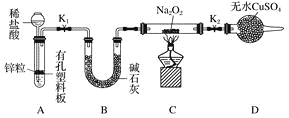
步驟1:按上圖組裝儀器(圖中夾持儀器省略),檢查氣密性,裝入藥品。
步驟2:打開K1、K2,產生的氫氣流經裝有Na2O2的硬質玻璃管,一段時間后,沒有任何現象。
步驟3:檢驗H2的純度后,開始加熱,觀察到硬質玻璃管內Na2O2開始熔化,淡黃色的粉末變成了白色固體,干燥管內硫酸銅未變藍色。
步驟4:反應后撤去酒精燈,待硬質玻璃管冷卻后關閉K1。
①添加稀鹽酸的儀器名稱是____________;B裝置的作用是________。
②必須檢驗氫氣純度的原因是__________________________________________________。
③設置裝置D的目的是________________________________________________________。
④你得到的結論是____________(若能反應請用化學方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗.
Ⅰ.(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:______與鹽酸反應最劇烈,____與鹽酸反應的速度最慢;____與鹽酸反應產生的氣體最多.
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為______________________________;
(3)將NaOH溶液與NH4Cl溶液混合生成NH3·H2O,從而驗證NaOH的堿性大于NH3·H2O,繼而可以驗證Na的金屬性大于N,你認為此設計是否合理?并說明理由:_________,________________;
Ⅱ.利用圖裝置可驗證同主族元素非金屬性的變化規律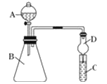
(4)干燥管D的作用為_______________;
(5)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3、C中加Na2SiO3溶液,觀察到C中溶液________________________的現象,即可證明.但有的同學認為鹽酸具有揮發性,可進入C中干擾實驗,應在兩裝置間添加裝有______________溶液的洗氣瓶.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com