
 的是 。
的是 。 科目:高中化學 來源:不詳 題型:單選題
| A.②④ | B.①②③ | C.①③ | D.①②③④ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
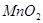 )的過程中,將它與濃鹽酸混合加熱,產生了一種黃綠色、刺激性氣味的氣體——氯氣。某學生使用這一原理設計如圖所示的實驗裝置,并且利用制得的氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應),據此回答下列問題:
)的過程中,將它與濃鹽酸混合加熱,產生了一種黃綠色、刺激性氣味的氣體——氯氣。某學生使用這一原理設計如圖所示的實驗裝置,并且利用制得的氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應),據此回答下列問題: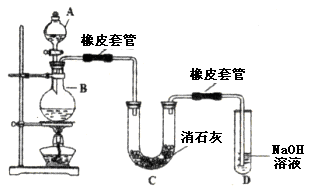
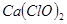 產率太低,經分析并查閱資料發現,主要原因是在U形管中存在兩個副反應:
產率太低,經分析并查閱資料發現,主要原因是在U形管中存在兩個副反應: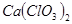 ,為避免此副反應的發生,可采取的措施是______________________________。
,為避免此副反應的發生,可采取的措施是______________________________。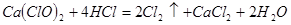 ,該反應中每生成
,該反應中每生成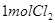 ,轉移電子的物質的量為__________
,轉移電子的物質的量為__________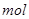 ,被氧化的
,被氧化的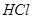 的物質的量為__________
的物質的量為__________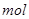 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效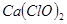 的含量大小的標志。已知:
的含量大小的標志。已知: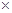 100%,該漂粉精的有效氯為65%,則該漂粉精中
100%,該漂粉精的有效氯為65%,則該漂粉精中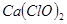 的質量分數為__________(保留一位小數)。
的質量分數為__________(保留一位小數)。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
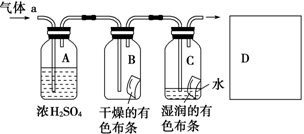
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com