
【題目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的幾種,為確定其成分,完成了如下實驗
中的幾種,為確定其成分,完成了如下實驗![]() 已知:
已知:![]()
![]() 根據實驗現象,所得結論錯誤的是
根據實驗現象,所得結論錯誤的是![]()
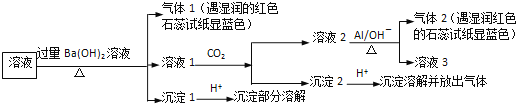
A.沉淀1加酸部分溶解,則含![]() 和
和![]()
B.可能含![]() 、
、![]()
C.沉淀2加酸溶解,則含![]()
D.氣體1遇水顯堿性,則含![]()
【答案】C
【解析】
試樣溶液中加入過量![]() 并加熱,生成的氣體1能使濕潤的紅色石蕊試紙變藍色,說明氣體1是
并加熱,生成的氣體1能使濕潤的紅色石蕊試紙變藍色,說明氣體1是![]() ,則試樣中含有
,則試樣中含有![]() ;
;
向濾液中通入![]() ,得到溶液2、沉淀2,溶液2中加入Al,生成氣體2,該氣體能使濕潤紅色石蕊試紙變藍色,說明含有氣體2是
,得到溶液2、沉淀2,溶液2中加入Al,生成氣體2,該氣體能使濕潤紅色石蕊試紙變藍色,說明含有氣體2是![]() ,根據已知條件知,溶液2中含有
,根據已知條件知,溶液2中含有![]() ,根據元素守恒知,原溶液中含有
,根據元素守恒知,原溶液中含有![]() ;
;
濾液1中通入![]() ,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出氣體,說明沉淀2是碳酸鋇等難溶性碳酸鹽;
,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出氣體,說明沉淀2是碳酸鋇等難溶性碳酸鹽;
沉淀1加入酸后,沉淀部分溶解,硫酸鋇不溶于酸,說明原來溶液中含有![]() ,能和過量
,能和過量![]() 反應生成能溶于酸的沉淀,根據離子知,該沉淀為
反應生成能溶于酸的沉淀,根據離子知,該沉淀為![]() ,所以溶液中含有
,所以溶液中含有![]() ,
,
A.通過以上分析知,沉淀1加酸部分溶解,試樣中肯定存在![]() 、
、![]() ,選項A正確;
,選項A正確;
B、依據分析,不能確定溶液中是否存在![]() 、
、![]() ,選項B正確;
,選項B正確;
C、通過以上分析知,試樣中不能確定是否含有![]() ,選項C錯誤;
,選項C錯誤;
D、遇水顯堿性的氣體為氨氣,選項D正確;
答案選C。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】水合肼![]() 是無色、有強還原性的液體,實驗室制備水合肼的原理為
是無色、有強還原性的液體,實驗室制備水合肼的原理為![]() 據此,某學生設計了下列實驗.
據此,某學生設計了下列實驗.
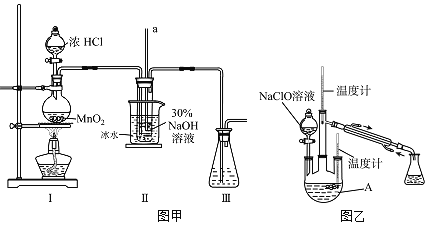
(制備NaClO溶液)實驗裝置如圖甲所示![]() 部分夾持裝置已省略
部分夾持裝置已省略![]()
已知:3NaClO![]()
![]()
(1)配制![]() 溶液時,所需玻璃儀器除量筒外還有______
溶液時,所需玻璃儀器除量筒外還有______![]() 填字母
填字母![]() 。
。
A.容量瓶![]() 燒杯
燒杯![]() 移液管
移液管![]() 玻璃棒
玻璃棒
(2)裝置Ⅰ中發生的離子反應方程式是______;Ⅱ中玻璃管a的作用為______;為了提高NaClO的產率,需對Ⅰ中產生的![]() 進行凈化,所用試劑是______;Ⅱ中用冰水浴控制溫度在
進行凈化,所用試劑是______;Ⅱ中用冰水浴控制溫度在![]() 以下,其主要目的______。
以下,其主要目的______。
(制取水合肼)實驗裝置如圖乙所示
(3)儀器A的名稱為______;反應過程中,如果分液漏斗中溶液的滴速過快,部分![]() 參與A中反應并產生大量氮氣,產品產率因此降低,請寫出降低產率的相關化學反應方程式______;充分反應后,加熱蒸餾A內的溶液即可得到水合肼的粗產品。
參與A中反應并產生大量氮氣,產品產率因此降低,請寫出降低產率的相關化學反應方程式______;充分反應后,加熱蒸餾A內的溶液即可得到水合肼的粗產品。
(測定肼的含量)
(4)稱取餾分![]() ,加水配成
,加水配成![]() 溶液,在一定條件下,用
溶液,在一定條件下,用![]() 的
的![]() 溶液滴定.已知:
溶液滴定.已知:![]()
![]() 滴定時,可以選用的指示劑為______;
滴定時,可以選用的指示劑為______;
![]() 實驗測得消耗
實驗測得消耗![]() 溶液的平均值為
溶液的平均值為![]() ,餾分中
,餾分中![]() 的質量分數為______。
的質量分數為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
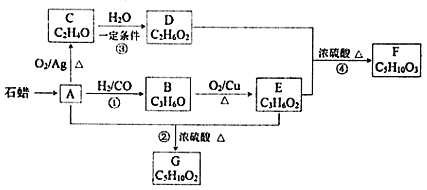
【題目】已知A與![]() 、CO形成B,B能發生銀鏡反應,C分子中只有一種氫,相關物質轉化關系如下
、CO形成B,B能發生銀鏡反應,C分子中只有一種氫,相關物質轉化關系如下![]() 含有相同官能團的有機物通常具有相似的化學性質
含有相同官能團的有機物通常具有相似的化學性質![]() :
:
請回答:
![]() 有機物C的結構簡式是______,反應②的反應類型是______。
有機物C的結構簡式是______,反應②的反應類型是______。
![]() 寫出一定條件下發生反應①的化學方程式______。
寫出一定條件下發生反應①的化學方程式______。
![]() 下列說法不正確的是______
下列說法不正確的是______![]() 填字母
填字母![]() 。
。
A.化合物A屬于烴
B.化合物D含有兩種官能團
C.用金屬鈉無法鑒別化合物F、G
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國航天航空事業蒸蒸日上,航天航空的關鍵技術是火箭,火箭燃料有液氫、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。請回答下列問題:
等。請回答下列問題:
(1)已知肼的結構簡式可表示為![]() 。
。
①肼分子中的化學鍵類型為 _______________________。
②肼在氧氣中燃燒生成無毒的物質,則反應中肼斷裂的化學鍵有N—H鍵、_______________________,新形成的化學鍵有_______________________ 。
③根據肼燃燒過程中的能量變化,說明反應物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氫燃料汽車中氫的燃燒與火箭中氫的燃燒最大的不同在于前者使用的是空氣作氧化劑,而后者使用的是液氧。火箭中不能使用液化空氣,原因是_______________________ 。
(3)火箭發射前,當液氫、液氧加到一定量后,技術人員還要不停地補加,請你說出這種做法的原因_______________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中各微粒的濃度關系正確的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等體積、等物質的量濃度的乙酸溶液和氫氧化鈉溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的飽和水溶液中通入NH3,測得含氮(或含碳)各微粒的分布分數(平衡時某種微粒的濃度占各種微粒濃度之和的分數)與pH的關系如圖所示。下列說法錯誤的是 ( )
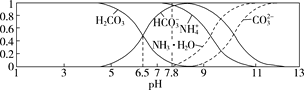
A.常溫下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3時,NH4+和HCO3-濃度都逐漸減小
C.NH4HCO3溶液中存在關系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.當溶液的pH=9時,溶液中存在下列關系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀![]() 是一種常用氧化劑,主要用于化工、防腐及制藥工業等。以軟錳礦
是一種常用氧化劑,主要用于化工、防腐及制藥工業等。以軟錳礦![]() 主要成分為
主要成分為![]() 為原料生產高錳酸鉀的工藝路線如下:
為原料生產高錳酸鉀的工藝路線如下:
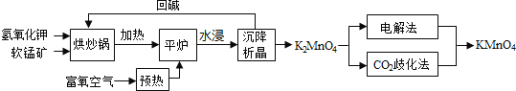
回答下列問題:
![]() 原料軟錳礦與氫氧化鉀按1:1的比例在“烘炒鍋”中混配,混配前應將軟錳礦粉碎,其作用是 __________________________________________;
原料軟錳礦與氫氧化鉀按1:1的比例在“烘炒鍋”中混配,混配前應將軟錳礦粉碎,其作用是 __________________________________________;
![]() “平爐”中發生的化學方程式為 _______________________________;
“平爐”中發生的化學方程式為 _______________________________;
![]() “平爐”中需要加壓,其目的是 _______________________________;
“平爐”中需要加壓,其目的是 _______________________________;
![]() 將
將![]() 轉化為
轉化為![]() 的生產有兩種工藝:
的生產有兩種工藝:
![]() “
“![]() 歧化法”是傳統工藝,即在
歧化法”是傳統工藝,即在![]() 溶液中通入
溶液中通入![]() 氣體,使體系呈中性或弱酸性,
氣體,使體系呈中性或弱酸性,![]() 發生歧化反應,反應中生成
發生歧化反應,反應中生成![]() ,
,![]() 和 __________________
和 __________________![]() 寫化學式
寫化學式![]() ;
;
![]() “電解法”為現代工藝,即電解
“電解法”為現代工藝,即電解![]() 水溶液,電解槽中陽極發生的電極反應為______________________________________________;
水溶液,電解槽中陽極發生的電極反應為______________________________________________;
![]() “電解法”和“
“電解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理論利用率之比為______;
的理論利用率之比為______;
![]() 高錳酸鉀純度的測定:稱取
高錳酸鉀純度的測定:稱取![]() 樣品,溶解后定容于100mL容量瓶中,搖勻。取濃度為
樣品,溶解后定容于100mL容量瓶中,搖勻。取濃度為![]() 的
的![]() 標準溶液
標準溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的體積為
溶液平行滴定三次,平均消耗的體積為![]() ,該樣品的純度為_____________
,該樣品的純度為_____________![]() 列出計算式即可,已知
列出計算式即可,已知![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下將40g已磨成粉末的![]() 和
和![]() 置于250mL錐形瓶中,迅速攪拌使固體藥品混合均勻,再在玻璃管口懸掛一塊濕潤的紅色石蕊試紙(如圖所示)。請回答下列問題:
置于250mL錐形瓶中,迅速攪拌使固體藥品混合均勻,再在玻璃管口懸掛一塊濕潤的紅色石蕊試紙(如圖所示)。請回答下列問題:
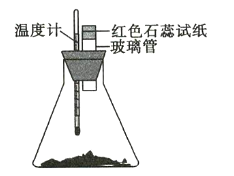
(1)濕潤的紅色石蕊試紙發生的變化是_________________,其原因是_______。
(2)溫度計的變化是_______________________,其原因是_______________________ 。
(3)錐形瓶中發生反應的化學方程式為__________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚乙炔能夠導電,下列關于聚乙炔(![]() )和聚合物M(
)和聚合物M(![]() )的說法正確的是( )
)的說法正確的是( )
A.兩種聚合物的單體互為同系物
B.聚合物M的單體中含有碳碳雙鍵
C.聚合物M的相對分子質量是聚乙炔的兩倍
D.兩種聚合物的單體各1 mol,分別與Br2發生加成反應時最多消耗Br2的物質的量之比為2:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com