
【題目】下列各圖敘述正確的是![]()

A.甲表示![]() 與
與![]() 發生反應過程中的能量變化,
發生反應過程中的能量變化,![]() 的燃燒熱為
的燃燒熱為![]()
B.乙表示恒溫恒容條件下反應![]() 中,各物質的濃度與其速率之間的關系,其中交點A對應的狀態為化學平衡狀態
中,各物質的濃度與其速率之間的關系,其中交點A對應的狀態為化學平衡狀態
C.丙表示A、B兩物質的溶解度隨溫度變化情況,將![]() 時A、B的飽和溶液分別升溫至
時A、B的飽和溶液分別升溫至![]() 時,溶質的質量分數
時,溶質的質量分數![]()
D.丁表示室溫下,將![]() 鹽酸滴入
鹽酸滴入![]()
![]() 氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線
氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線
【答案】D
【解析】
A.圖象中1mol氫氣完全燃燒生成的是水蒸氣時放熱![]() ,不是氫氣的燃燒熱,故A錯誤;
,不是氫氣的燃燒熱,故A錯誤;
B.交點A對應的狀態是二氧化氮和四氧化二氮表示的反應速率相同,不能證明反應達到平衡,故B錯誤;
C.A、B兩物質的溶解度隨溫度變化情況,![]() 時,AB溶解度相同,A、B的飽和溶液質量分數相同,分別升溫至
時,AB溶解度相同,A、B的飽和溶液質量分數相同,分別升溫至![]() 時,溶解度增大,但溶液濃度不變溶質的質量分數
時,溶解度增大,但溶液濃度不變溶質的質量分數![]() ,故C錯誤;
,故C錯誤;
D.鹽酸和氨水恰好完全反應,放熱最多,再加鹽酸溫度降低只能是加入鹽酸的溫度低于溶液溫度,這才是溫度下降的原因;![]() 溶液呈中性,則
溶液呈中性,則![]() ,根據電荷守恒可知
,根據電荷守恒可知![]() ,隨著鹽酸滴入發生中和反應,恰好反應生成氯化銨溶液水解呈酸性,圖象符合反應過程中濃度變化,溫度變化,故D正確;
,隨著鹽酸滴入發生中和反應,恰好反應生成氯化銨溶液水解呈酸性,圖象符合反應過程中濃度變化,溫度變化,故D正確;
故選:D。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下圖裝置中:b電極用金屬M制成,a、c、d為石墨電極,接通電源,金屬M沉積于b極,b為陰極。同時a、d電極上產生氣泡。試回答

(1)a連接電源的___極。b極的電極反應式為______。
(2)電解開始時,在B燒杯的中央,滴幾滴淀粉溶液,你能觀察到的現象是:___________。此時C極上的電極反應式為:_________。
(3)當d極上收集到44.8mL氣體(標準狀況)時停止電解,a極上的電極反應式為___________,若在b電極上沉積金屬M的質量為0.432g,則此金屬的摩爾質量為 ______ 。
(4)電解停止后加蒸餾水使A燒杯中的溶液體積仍為200mL。取該溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,當加入25.00mL這種溶液時剛好沉淀完全。試計算電解前A燒杯中MNO3溶液的物質的量濃度為____________?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2H2O2(1)=2H2O(1)+O2(g)反應過程中的能量變化曲線如圖所示,下列說法不正確的是

A. 該反應的△H<0,△S>0
B. 途徑Ⅱ與途徑I相比,可能是加了催化劑
C. 其他條件相同時,產生相同體積的氧氣時放出的熱量:途徑I >途徑Ⅱ
D. 其他條件相同時,產生相同體積的氧氣所需的時間:途徑I>途徑Ⅱ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)25℃時,pH=3的醋酸和pH=11的氫氧化鈉溶液等體積混合后,溶液呈________(填“酸性”“中性”或“堿性”)。
(2)25℃時,將m mol·L-1的醋酸和n mol·L-1的氫氧化鈉溶液等體積混合后,溶液的pH=7,則溶液中c(CH3COO-)+c(CH3COOH)=________,m與n的大小關系是m________n(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A是一種重要的化工原料,以A為主要起始原料,通過下列途徑可以合成高分子材
料PA及PC。

試回答下列問題
(1)B的化學名稱為________,B到C的反應條件是_____________。
(2)E到F的反應類型為__________,高分子材料PA的結構簡式為________。
(3)由A生成H的化學方程式為______________________。
(4)實驗室檢驗有機物A,可選擇下列試劑中的_____________。
a.鹽酸 b.FeCl3溶液 C. NaHCO3溶液 d.濃溴水
(5)E的同分異構中,既能與碳酸氫鈉溶液反應、又能發生銀鏡反應的有機物共有_____種。其中核磁共振氫諧圖有5組峰,且峰面積之比為6:1:1:1:1的物質的結構簡式為____。
(6)由B通過三步反應制備1.3-環己二烯的合成路線為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是
2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是

A. ①壓強對反應的影響(p2>p1) B. ②溫度對反應的影響
C. ③平衡體系增加N2對反應的影響 D. ④催化劑對反應的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CoCl2·6H2O是一種飼料營養強化劑。一種利用水鈷礦(主要成分為Co2O3、Co(OH)3,還含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工藝流程如下:

已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性條件下,ClO3-不會氧化Co2+,ClO3-轉化為Cl-;
③部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:(金屬離子濃度為:0.01mol/L)
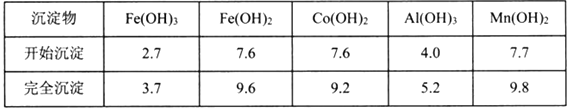
④CoCl2·6H2O熔點為86℃,加熱至110~120℃時,失去結晶生成無水氯化鈷。
請回答:
(1)“加Na2CO3調pH至5.2”,過濾所得到的沉淀Ⅹ成分為___________。
(2)萃取劑對金屬離子的萃取率與pH的關系如圖所示,萃取劑使用的適宜pH范圍是___________。(填選項序號字母)
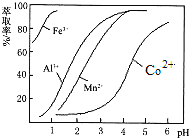
A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(3)為測定粗產品中CoCl2·6H2O含量,稱取2g的粗產品溶于水,配成100mL溶液,取出20mL置于錐形瓶,加入K2CrO4做指示劑( Ag2CrO4為磚紅色沉淀),用0.2mol/L的AgNO3溶液滴定至終點,重復2-3次,平均消耗AgNO3標準溶液10.00mL。該粗產品中CoCl2·6H2O的質量分數為___________。用K2CrO4做指示劑時,需要控制溶液pH值為6.5~10.5,試分析原因______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(亞硝酸鈉(NaNO2)是工業鹽的主要成分,在漂白、電鍍等方面應用廣泛。實驗室利用下圖裝置制備亞硝酸鈉,并測定所制亞硝酸鈉的純度。(加熱裝置及部分夾持裝置已略去)
Ⅱ.亞硝酸鈉純度的測定。
當Na2O2完全反應后,E中產生的固體除NaNO2外,還可能有NaNO3。測定亞硝酸鈉純度的步驟如下:
步驟一:取反應后的固體4.30 g溶于稀硫酸,向所得溶液中加入足量KI,將溶液中的NO2-和NO3-全部還原為NO,并通入足量N2,將NO全部趕出,最后將溶液稀釋至1000 mL。
步驟二:取上述所得溶液10 mL,用淀粉作指示劑,用0.050 mol/L的Na2S2O3標準液滴定,發生的反應為I2+2Na2S2O3=2NaI+Na2S4O6,最終消耗Na2S2O3溶液體積為16.00 mL。
(1)步驟二中達到滴定終點的標志為______________________。
(2)混合固體中NaNO2的質量分數為________。(保留三位有效數字)
(3)若在滴定終點讀取滴定管刻度時,仰視標準液液面,則測得亞硝酸鈉的純度________。(填“偏高”“偏低”或“無影響”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將0.1000 mol·L-1鹽酸滴入20.00 mL 0.100 0mol·L-1的某一元堿MOH溶液中,溶液的pH隨加入鹽酸體積變化曲線如下圖所示。下列有關說法不正確的是( )

A.該一元堿的電離方程式為MOH = M++OH-
B.a、b、c三點中,b點水的電離程度最大
C.室溫下,MOH的電離常數Kb=1×10-5 mol·L-1
D.b點:c (M+)=c (Clˉ)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com