
【題目】一種新型含硅阻燃劑的合成路線如下。請回答相關問題:

(1)化合物A轉化為B的方程式為_____,B中官能團名稱是______。
(2)H的系統命名為___,H的核磁共振氫譜共有___組峰。
(3)H→I的反應類型是___
(4)D的分子式為______,反應B十I→D中Na2CO3的作用是___。
(5)F由E和環氧乙烷按物質的量之比為1:1進行合成,F的結構簡式為___。
(6)D的逆合成分析中有一種前體分子C9H10O2,符合下列條件的同分異構體有___種。①核磁共振氫譜有4組峰;②能發生銀鏡反應;③與FeCl3發生顯色反應。
【答案】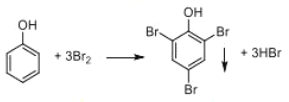 溴原子、(酚)羥基 3-氯-1-丙烯 3 氧化反應
溴原子、(酚)羥基 3-氯-1-丙烯 3 氧化反應 ![]() 吸收生成的HCl,提高反應產率
吸收生成的HCl,提高反應產率 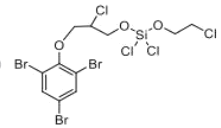 2
2
【解析】
⑴苯酚和濃溴水反應生成三溴苯酚,三溴苯酚中有官能團溴原子、酚羥基。
⑵H![]() 系統命名時,以雙鍵這一官能團為主來命名,H的核磁共振氫譜與氫原子的種類有關,有幾種氫原子就有幾組峰。
系統命名時,以雙鍵這一官能團為主來命名,H的核磁共振氫譜與氫原子的種類有關,有幾種氫原子就有幾組峰。
⑶H→I的反應,分子中多了一個氧原子,屬于氧化反應。
⑷根據D的結構式得出分子式,B十I→D中有 HCl 生成,用Na2CO3吸收 HCl 。
⑸E與環氧乙烷按物質的量之比為1:1進行合成,環氧乙烷發生開環反應,類似于D→E的反應。
⑹根據核磁共振氫譜有4組峰,能發生銀鏡反應,與FeCl3發生顯色反應,可得有機物中含有四種不同位置的氫原子,含有醛基,含有酚羥基。
⑴化合物A為苯酚,和濃溴水反應生成三溴苯酚,方程式為 ,三溴苯酚
,三溴苯酚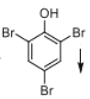 中含有官能團為溴原子、(酚)羥基,故答案為:
中含有官能團為溴原子、(酚)羥基,故答案為: ,溴原子、(酚)羥基;
,溴原子、(酚)羥基;
⑵H ![]() 系統命名法以雙鍵為母體,命名為3-氯-1-丙烯,其中氫原子的位置有三種,核磁共振氫譜共有3組峰,所以故答案為:3-氯-1-丙烯,3;
系統命名法以雙鍵為母體,命名為3-氯-1-丙烯,其中氫原子的位置有三種,核磁共振氫譜共有3組峰,所以故答案為:3-氯-1-丙烯,3;
⑶![]() 分子中多了一個氧原子是氧化反應,故答案為:氧化反應;
分子中多了一個氧原子是氧化反應,故答案為:氧化反應;
⑷根據D的結構簡式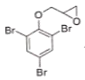 可得分子式
可得分子式![]() ,反應B十I→D中有HCl生成,為促進反應向右進行,可以將HCl吸收,
,反應B十I→D中有HCl生成,為促進反應向右進行,可以將HCl吸收,![]() 可起到吸收HCl的作用,故答案為:
可起到吸收HCl的作用,故答案為:![]() ,吸收生成的HCl,提高反應產率;
,吸收生成的HCl,提高反應產率;
⑸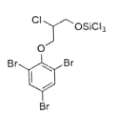 與環氧乙烷按物質的量之比為1:1進行合成,環氧乙烷發生開環反應,類似于D→E的反應,生成
與環氧乙烷按物質的量之比為1:1進行合成,環氧乙烷發生開環反應,類似于D→E的反應,生成 ,故答案為:
,故答案為: ;
;
⑹根據核磁共振氫譜有4組峰,能發生銀鏡反應,與FeCl3發生顯色反應,可得有機物中含有四種不同位置的氫原子,含有醛基,含有酚羥基,符合題意的有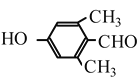 和
和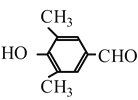 兩種,故答案為:2種。
兩種,故答案為:2種。


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】鉻、鉬![]() 、鎢
、鎢![]() 都是ⅥB族元素,且原子序數依次增大,它們的單質和化合物在生活、生產中有廣泛應用。
都是ⅥB族元素,且原子序數依次增大,它們的單質和化合物在生活、生產中有廣泛應用。
![]() 鉻元素的最高化合價為________;基態鉬原子的核外電子排布類似于基態鉻原子,其原子核外有________個未成對電子。
鉻元素的最高化合價為________;基態鉬原子的核外電子排布類似于基態鉻原子,其原子核外有________個未成對電子。
![]() 鉬可作有機合成的催化劑。例如,苯甲醛被還原成環己基甲醇。
鉬可作有機合成的催化劑。例如,苯甲醛被還原成環己基甲醇。
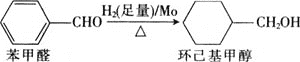
![]() 環己基甲醇分子中采取
環己基甲醇分子中采取![]() 雜化的原子是________
雜化的原子是________![]() 寫元素符號
寫元素符號![]() 。
。
![]() 環己基甲醇的沸點高于苯甲醛,其原因是________。
環己基甲醇的沸點高于苯甲醛,其原因是________。
![]() 鉻離子
鉻離子![]() 能形成多種配合物,例如
能形成多種配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位數指配位原子總數。上述配合物中,
已知配合物的中心粒子的配位數指配位原子總數。上述配合物中,![]() 的配位數為________。
的配位數為________。
![]() 上述配合物中的非金屬元素按電負性由小到大的順序排列為________。
上述配合物中的非金屬元素按電負性由小到大的順序排列為________。
![]() 鉻的一種氧化物的晶胞結構如圖所示。
鉻的一種氧化物的晶胞結構如圖所示。
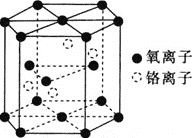
![]() 該氧化物的化學式為________。
該氧化物的化學式為________。
![]() 已知晶胞底面的邊長為acm,晶胞的高為bcm,
已知晶胞底面的邊長為acm,晶胞的高為bcm,![]() 代表阿伏加德羅常數的值,該鉻的氧化物的摩爾質量為
代表阿伏加德羅常數的值,該鉻的氧化物的摩爾質量為![]() 。該晶體的密度為________
。該晶體的密度為________![]() 用含a、b、
用含a、b、![]() 和M的代數式表示
和M的代數式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量Zn粉與![]() 的稀硫酸充分反應。為了減慢此反應的速率而不改變H2的產量,可以使用如下方法中的( )
的稀硫酸充分反應。為了減慢此反應的速率而不改變H2的產量,可以使用如下方法中的( )
①加Na2SO4溶液
②改用![]() 的稀鹽酸
的稀鹽酸
③改用![]() 的稀硝酸
的稀硝酸
④減壓
⑤冰水浴
⑥加![]() 溶液
溶液
A.①⑤B.③⑤⑥C.①②⑤⑥D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗探究小組研究320K時N2O5的分解反應:![]() 。如圖是該小組根據所給表格中的實驗數據繪制的。下列有關說法正確的是( )
。如圖是該小組根據所給表格中的實驗數據繪制的。下列有關說法正確的是( )
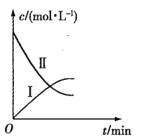
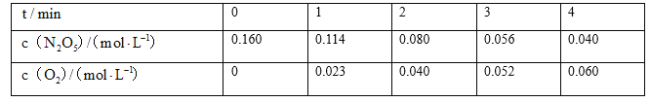
A.曲線I是N2O5的濃度變化曲線
B.曲線Ⅱ是N2O5的濃度變化曲線
C.N2O5的濃度越大,反應速率越快
D.O2的濃度越大,反應速率越快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相比鋰離子電池,鈉離子電池具有原材料豐富、成本低、無過放負載電特性等優點。一種可充電鈉離子電池的工作原理如圖所示(兩電極材料均不溶于水,P為![]() 價),下列說法正確的是( )
價),下列說法正確的是( )

A.放電過程中Ti元素的化合價由![]() 降低到
降低到![]()
B.充放電過程中電解質溶液中![]() 基本保持不變
基本保持不變
C.充電過程中![]() 通過離子交換膜從右室移向左室
通過離子交換膜從右室移向左室
D.充電時陰極反應為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下圖裝置用正丁醇合成正丁醛。相關數據如下:
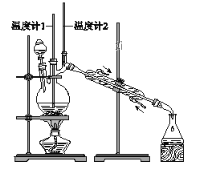
物質 | 沸點/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列說法中,不正確的是( )
A. 為防止產物進一步氧化,應將酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向獲得的粗正丁醛中加入少量金屬鈉,檢驗其中是否含有正丁醇
C. 反應結束,將餾出物倒入分液漏斗中,分去水層,粗正丁醛從分液漏斗上口倒出
D. 當溫度計1示數為90~95℃,溫度計2示數在76℃左右時,收集產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是大氣中含量最多的氣體,研究氮及其化合物對人類有重要的意義。
(1)合成氨的原理為:N2(g)+3H2![]() 2NH3△H=-92.4kJ/mol
2NH3△H=-92.4kJ/mol
①將一定量的N2(g)和H2(g)放入1L的密閉容器中,在500℃、2×107Pa下達到平衡,平衡時測得N2為0.1 mol,H2為0.3 mol,NH3為0.1 mol。該條件下H2的轉化率為______。
此溫度下該反應的平衡常數K=__________。
②欲提高H2的轉化率,下列措施可行的是___________。
a.向容器中按原比例再充入原料氣
b.向容器中再充入惰性氣體
c.改變反應的催化劑
d.液化生成物分離出氨
(2)在2L密閉容器中,800℃時反應2NO(g)+O2(g) ![]() 2NO2(g) △H<0體系中,各成分濃度隨時間的變化如圖:
2NO2(g) △H<0體系中,各成分濃度隨時間的變化如圖:
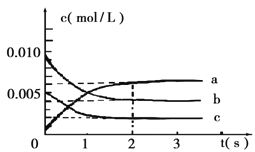
①用O2表示從0~2s內該反應的平均速率υ=___________。
②能說明該反應已經達到平衡狀態的是_________。
a.υ(NO2)=2υ(O2)
b.容器內壓強保持不變
c.υ逆(NO)=2υ正(O2)
d.容器內的密度保持不變
③為使該反應的反應速率增大,且平衡向正反應方向移動的是_________。
a.及時分離出NO2氣體 b.適當升高溫度
c.增大O2的濃度 d.選擇高效的催化劑
(3)汽車尾氣中含有CO、NO2等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣體。4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1對于該反應,溫度不同(T2>T1)、其他條件相同時,下列圖像正確的是______(填代號)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1對于該反應,溫度不同(T2>T1)、其他條件相同時,下列圖像正確的是______(填代號)。
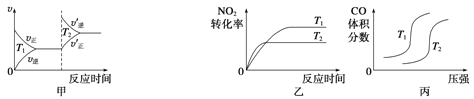
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2020年化學科學家用微生物燃料電池作電源進行模擬消除酸性工業廢水中的重鉻酸根離子(Cr2O72-)的示意圖如圖所示,反應一段時間后,在裝置②中得到Fe(OH)3和Cr(OH)3兩種沉淀。已知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O。下列說法錯誤的是( )

A.裝置①中,a極的電極反應為HS--8e-+4H2O=SO42-+9H+
B.向裝置②中加入適量Na2SO4,其主要作用是增強溶液的導電性
C.裝置①中,b極上消耗的n(O2)與裝置②中惰性電極上生成的n(生成物)相等
D.當裝置①中有0.6mol H+通過質子交換膜時,裝置②中產生0.4mol沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中的曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素的有關性質):
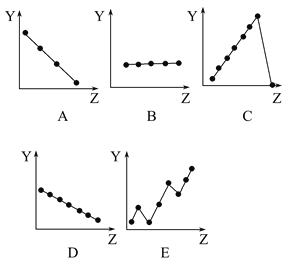
把與元素有關性質相符的曲線的標號填入相應括號中:
(1)ⅡA族元素原子的價電子數___________;
(2)第三周期元素的最高正化合價___________;
(3)F-、Na+、Mg2+、Al3+四種離子的離子半徑___________;
(4)第二周期元素的原子半徑(不包括稀有氣體) ___________;
(5)第二周期元素的第一電離能 ___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com