
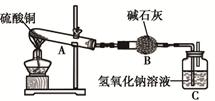
一定溫度下,硫酸銅受熱分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被堿石灰和氫氧化鈉溶液吸收。利用下圖裝置加熱硫酸銅粉末直至完全分解。硫酸銅粉末質量為10.0g,完全分解后,各裝置的質量變化關系如下表所示。
| 裝置 | A(試管+粉末) | B | C |
| 反應前 | 42.0g | 75.0g | 140.0g |
| 反應后 | 37.0g | 79.5g | 140.0g |
 3CuO + SO3↑ + 2SO2↑ + O2↑
3CuO + SO3↑ + 2SO2↑ + O2↑ 4CuO + 2SO3↑ + 2SO2↑ + O2↑
4CuO + 2SO3↑ + 2SO2↑ + O2↑ 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑ 6CuO + 4SO3↑ + 2SO2↑ + O2↑
6CuO + 4SO3↑ + 2SO2↑ + O2↑ B
解析試題分析:由C裝置中數據可知,堿石灰完全吸收了二氧化硫和三氧化硫,然后根據質量守恒定律分析每個裝置的質量變化情況,從而分析反應中各物質的質量。根據質量守恒定律分析,反應生成氣體的質量為42.0g-37.0g=5g,生成氧化銅的質量為10g-5g=5g;干燥管完全吸收了二氧化硫和三氧化硫,其質量為79.5g-75g=4.5g,生成的氧氣的質量為5g-4.5g=0.5g;則參加反應的硫酸銅和生成氧化銅及生成的氧氣的質量比為10g:5g:0.5g=20:10:1,表現在化學方程式中的化學計量數之比為(20÷160):(10÷80):(1÷32)=4:4:1,從題干中可以看出,只有B答案符合這個比例,答案選B。
考點:根據硫酸銅分解方程式的判斷、質量守恒定律的應用


科目:高中化學 來源: 題型:單選題
在一密閉容器中有CO、H2、O2共16.5g和足量的Na2O2,用電火花引燃,使其完全反應,Na2O2增重7.5g,則原混合氣體中O2的質量分數是
| A.54.5% | B.40% | C.36% | D.33.3% |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設nA為阿伏加德羅常數的數值,下列說法正確的是
| A.16g CH4含有10nA個電子 |
| B.常溫常壓下,22. 4L Cl2含有2nA個Cl原子 |
| C.1 mol Cu與足量稀HNO3反應,轉移3nA個電子 |
| D.1L 0.1 mol?L-1Na2SO3溶液中含有0. 1nA個SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
用NA表示阿伏加德羅常數的值,下列敘述正確的是
| A.常溫下,1L 0.1mol/L的NH4NO3溶液中氮原子數為0.2NA |
| B.常溫常壓下,22.4L CH4含有4NA個C—H共價鍵 |
| C.2mol N2與2mol H2混合充分反應,轉移的電子數目為4NA |
| D.10L pH=1的硫酸溶液中含有的H+離子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
NA表示阿伏加德羅常數,下列敘述正確的是
| A.常溫下,9g H2O中含NA個O–H鍵 |
| B.1 molFe2+與足量稀硝酸反應,轉移3 NA個電子 |
| C.常溫常壓下,22. 4L SO2和O2的混合氣體中含2NA個氧原子 |
| D.1 L 0. 1 mol·L-1KAl(SO4)2溶液含0.1NA個Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設NA為阿伏加德羅常數的值,下列有關敘述正確的是
| A.1mol Cl2溶于足量水中轉移電子數為NA |
| B.在熔融狀態下,1molKHSO4完全電離出的陽離子數為2NA |
| C.標準狀況下,22.4LNO與CO2的混合氣體中含有的原子數為2NA |
| D.CaC2含有的π鍵的數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設NA表示阿伏加德羅常數的值,下列說法不正確的是
| A.T0C時,1 L pH=6的純水中,含有的OH-數目為1×10-6NA |
| B.12.0 g NaHSO4固體中含有的陽離子數目為0.1 NA |
| C.50 g 98%的濃硫酸中,所含的氧原子數目為2NA |
| D.1 molNa2O2與足量CO2充分反應轉移的電子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列各組物質中分子數相同的是( )
| A.2LCO和2LCO2 |
| B.9gH2O和標準狀況下11.2LCO2 |
| C.標準狀況下1molO2和22.4LH2O |
| D.0.2molH2和4.48LHCl氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(4分)取14.3g Na2CO3?XH2O 溶于水配成100m L 溶液,然后逐滴滴入稀鹽酸直至沒有氣體放出為止,用去鹽酸 20.0m L,并收集到1.12 L CO2(標準狀況)。試計算:
(1)稀鹽酸物質的量濃度為 mol/L;
(2)x值是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com