
【題目】(1)火藥是中國的“四大發明”之一,永遠值得炎黃子孫驕傲,也永遠會激勵著我們去奮發圖強。黑火藥在發生爆炸時,發生如下的反應:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化劑是 ,還原產物是 。電子轉移的總數為__________。
(2)國家衛生部在2000年前就決定逐步使用穩定、高效、無毒的二氧化氯取代氯氣消毒飲用水。已知二氧化氯溶于水時有亞氯酸根離子(ClO2-)生成,且氧化產物與還原產物的物質的量之比為1∶1。二氧化氯溶于水的反應方程式2ClO2 + H2O=HClO3 + HClO2,請用單線橋標明電子轉移方向和數目并指出氧化產物。2ClO2 + H2O=HClO3 + HClO2
 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案科目:高中化學 來源: 題型:
【題目】二茂鐵[(C5H5)2Fe]的發現是有機金屬化合物研究中具有里程碑意義的事件,它開辟了有機金屬化合物研究的新領域。已知二茂鐵熔點是173 ℃(在100 ℃時開始升華),沸點是249 ℃,不溶于水,易溶于苯、乙醚等非極性溶劑。下列說法不正確的是( )
A. 二茂鐵屬于分子晶體
B. 在二茂鐵結構中,C5H![]() 與Fe2+之間形成的化學鍵類型是離子鍵
與Fe2+之間形成的化學鍵類型是離子鍵
C. 已知:環戊二烯的結構式為: ,則其中僅有1個碳原子采取sp3雜化
,則其中僅有1個碳原子采取sp3雜化
D. C5H![]() 中一定含π鍵
中一定含π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L密閉容器內,800℃時反應2NO(g)+O2(g) ![]() 2NO2(g)體系中,n(NO)隨時間的變化如表:
2NO2(g)體系中,n(NO)隨時間的變化如表:
時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)寫出該反應的平衡常數表達式:K=________。已知:K300℃>K350℃,則該反應是________熱反應。
(2)圖中表示NO2的變化的曲線是________。用O2表示從0~2 s內該反應的平均速率v=________。
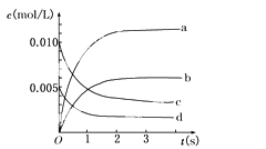
(3)能說明該反應已達到平衡狀態的是________。
a.v(NO2)=2v(O2)
b.容器內壓強保持不變
c.v逆(NO)=2v正(O2)
d.容器內密度保持不變
e.顏色不再改變
(4)能使該反應的反應速率增大,且平衡向正反應方向移動的是________
a.及時分離出NO2氣體 b.適當升高溫度 c.增大O2的濃度 d.選擇高效催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明缺硒將導致克山病。克山病是一種地方性心肌病,急重病人可發生猝死.營養學和流行病學界專家認為,成人每天硒的攝取量約在40~100μg之間就可滿足人體需要。根據資料,下列解釋不正確的是( )
A. 硒是人體必需的化學元素
B. 硒在人體的生長發育過程中的作用不可替代
C. 硒的作用重大,只要有了硒,人體就能正常生長發育
D. 硒是人體必需的微量元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2和NOx都是大氣污染物。
(1)汽車排放的尾氣中含CO和NO,汽車發動機工作時產生的NO和CO可通過催化轉化器轉化為兩種無污染的氣體,該反應的化學方程式是____________。
(2)采取還原法,用炭粉可將氮氧化物還原。
已知:① N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
則反應C(s)+2NO(g) = CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)利用氨水可以將SO2和NO2吸收,原理如下圖所示:
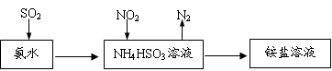
NO2被吸收的離子方程式是_________________________
(4)利用下圖所示裝置(電極均為惰性電極)也可吸收SO2,并用陰極排出的溶液吸收NO2。
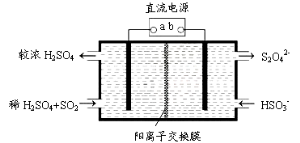
①b極的電極反應式為____________
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體,同時有SO32-生成。該反應離子方程式為____________
(5)已知水的比熱容為4.18×10-3 kJ·g-1·℃-1,10 g硫黃在O2中完全燃燒生成氣態SO2,放出的熱量能使500 g H2O的溫度由18 ℃升至62.4 ℃,則表示硫黃的燃燒熱的熱化學方程式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知牙膏摩擦劑由碳酸鈣、氫氧化鋁組成;牙膏中其他成分遇到鹽酸時無氣體產生。某興趣小組對摩擦劑成分及其含量進行以下探究:
Ⅰ.摩擦劑中氫氧化鋁的定性檢驗
取適量牙膏樣品,加水充分攪拌、過濾。
(1)往濾渣中加入過量NaOH溶液,過濾。氫氧化鋁與NaOH溶液反應的離子方程式是______________。
(2)往(1)所得濾液中通入過量二氧化碳,主要發生反應的離子方程式是 。
Ⅱ.牙膏樣品中碳酸鈣的定量測定
利用下圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,測定C中生成的BaCO3沉淀質量,以確定碳酸鈣的質量分數。
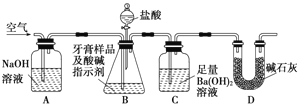
依據實驗過程回答下列問題:
(3)D裝置的作用是 ;
(4)實驗過程中需持續緩緩通入空氣。其作用除了可攪拌B、C中的反應物外,還有:______________。
(5)下列各項措施中,不能提高測定準確度的是________________(填標號)。
a.在加入鹽酸之前,應排凈裝置內的CO2氣體
b.滴加鹽酸不宜過快
c.在A~B之間增添盛有濃硫酸的洗氣裝置
d.在B~C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
(6)有人認為不必測定C中生成的BaCO3質量,只要測定裝置C在吸收CO2前后的質量差,一樣可以確定碳酸鈣的質量分數。實驗證明按此方法測定的結果明顯偏高,原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以氯化鈉和硫酸銨為原料制備氯化銨及副產品硫酸鈉的工藝流程如下:
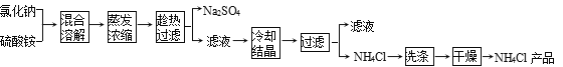
【查閱資料】
①上述流程所示物質中只有NH4Cl受熱易分解:NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化銨和硫酸鈉的溶解度隨溫度變化曲線如下圖所示:
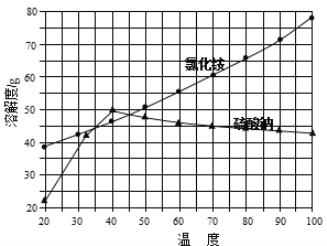
請回答下列問題:
(1)寫出氯化鈉和硫酸銨溶液混合得到硫酸鈉晶體的化學方程式: 。
(2)欲制備10.7 g NH4Cl,理論上需NaCl質量為 g。
(3)實驗室進行蒸發結晶用到的主要儀器除鐵架臺、鐵圈、酒精燈外,還要有 。
(4)“冷卻結晶”過程中,析出NH4Cl晶體的合適溫度為 。
(5)不用其它試劑,檢查NH4Cl產品是否純凈的方法:
操作步驟 | 現象 | 結論 |
取少量氯化銨產品于試管底部, | 表明氯化銨產品純凈 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學變化屬于加成反應的是
A.乙醇在銅作催化劑的條件下加熱和空氣的反應
B.乙烯通入溴的四氯化碳溶液中的反應
C.甲烷在光照條件下與氯氣發生的反應
D.苯與液溴在鐵粉作催化劑的條件下發生的反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com