
【題目】25℃時,進行下圖所示滴定并得到對應曲線。下列說法錯誤的是( )
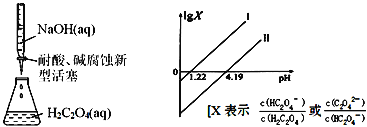
A.Ka2(H2C2O4)=10-4.19
B.直線Ⅰ中X=![]()
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ兩條直線的斜率均為1
【答案】B
【解析】
H2C2O4溶液中滴入NaOH溶液,先發生反應:H2C2O4+OH-=HC2O4-+H2O,隨著堿的不斷滴入,溶液的pH不斷增大;當H2C2O4完全反應后,HC2O4-與NaOH發生反應HC2O4-+OH-=C2O42-+H2O,所以直線Ⅰ為X=![]() ,直線Ⅱ為X=
,直線Ⅱ為X=![]() 。
。
A. 在pH=4.19點,Ka2(H2C2O4)=![]() =10-4.19,A正確;
=10-4.19,A正確;
B. 由以上分析可知,直線Ⅱ中X=![]() ,B錯誤;
,B錯誤;
C. 在NaHC2O4溶液中,HC2O4-![]() C2O42-+H+,HC2O4-+H2O
C2O42-+H+,HC2O4-+H2O![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O![]() H++OH-
H++OH-
由水電離出的c(OH-)=c(H+),則溶液中c(H+)-c(C2O42-)=c(OH-)-c(H2C2O4),從而得出c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-),C正確;
D. 直線Ⅰ,lg X=0時,pH=1.22,pH=0時,lg X=1.22(由平衡常數進行計算),從而得出其斜率為1;采用同樣的方法,可求出直線Ⅱ的斜率為1,D正確;
故選B。


科目:高中化學 來源: 題型:
【題目】現有以下幾種有機物:
①![]() ②
②![]() ③
③ ④
④![]() ⑤
⑤![]()
⑥![]() ⑦
⑦ ⑧
⑧![]() ⑨
⑨![]()
請利用上述給出的物質按要求回答下列問題:
(1)③的系統命名是________。
(2)用“>”表示①③④⑧熔沸點高低順序:________(填序號)。
(3)與③互為同系物的是________(填序號)。
(4)⑨的一氯代物同分異構體數目有________種。
(5)在120℃,![]() 條件下,某種氣態烴與足量的
條件下,某種氣態烴與足量的![]() 完全反應后,測得反應前后氣體的體積沒有發生改變,則該烴是________(填序號)。
完全反應后,測得反應前后氣體的體積沒有發生改變,則該烴是________(填序號)。
(6)寫出⑥在鐵作催化劑的條件下與液溴發生取代反應的化學方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,將3molA和1molB兩種氣體混合于固定容積2L的密閉容器中,發生如下反應:3A(g)+B(g)xC(g)+2D(g)。經2min該反應達到平衡狀態,生成0.8molD,測得C的濃度為0.8mol/L。則下列判斷錯誤的是
A.x=4
B.2min內B的反應速率為0.1mol·L-1·min-1
C.B的轉化率為40%
D.該溫度下平衡常數的值為1.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中屬于加成反應的是
A.2CH3COOH+Na2CO3![]() 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3-CH=CH2+Br2![]() CH3-CHBr-CH2Br
CH3-CHBr-CH2Br
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液,滴定曲線如圖。下列說法正確的是
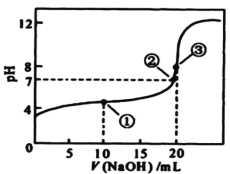
A.該滴定過程既能用甲基橙又能用酚酞作指示劑
B.點①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C.點②所示溶液中:c(Na+) =c(HA) +c(A-)
D.水的電離程度隨著NaOH溶液的滴入不斷增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCl3在現代工業生產中應用廣泛。某化學研究性學習小組模擬工業生產流程制備無水FeCl3,實驗裝置如下圖所示:
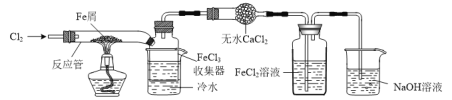
已知:無水FeCl3在空氣中易潮解,加熱易升華。
⑴通入Cl2和加熱反應管這兩步操作的先后順序是_____,原因是______。
⑵實驗后生成的FeCl3大部分進入收集器,少量沉積在反應管的右端。要使沉積得FeCl3進入收集器,可以進行的操作是________。
⑶洗氣瓶中的FeCl2溶液用于吸收未反應的Cl2。向反應后的洗氣瓶中滴加KSCN溶液,結果看到溶液先變紅后褪色,溶液褪色的可能原因是_______。
⑷洗氣瓶中生成的FeCl3溶液可用于吸收H2S氣體生成S。寫出吸收H2S氣體的離子反應方程式:_______。為檢測反應后溶液中是否存在Fe2+,甲同學提出可用酸性KMnO4溶液,乙同學提出酸性KMnO4溶液褪色不能證明存在Fe2+,理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素R、W、X、Y、Z的原子序數依次增大,R的簡單氫化物可用作制冷劑,X是短周期中金屬性最強的元素。Y的簡單離子在同周期元素的簡單離子中半徑最小,由W、X和Z三種元素形成的一種鹽溶于水后,加入稀鹽酸,有黃色沉淀(Z的單質)析出,同時產生有刺激性氣味的氣體(Z的氧化物)。下列說法正確的是( )
A. 原子半徑:Z>Y>X>W
B. Z的簡單氫化物的熱穩定性比W的強
C. Y的氧化物既可溶于R的最高價氧化物對應的水化物水溶液,也可溶于R的氫化物水溶液
D. X與W、Z形成的化合物不少于三種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物M是一種醫用高分子材料,可用于制造隱形眼鏡;以下是M、有機玻璃的原料H及合成橡膠(N)的合成路線。
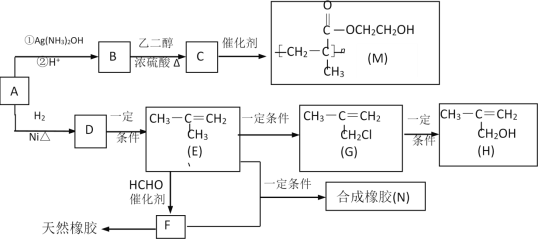
(1)A中含有的官能團是___(寫名稱)。
(2)寫出反應類型:D→E___;寫出反應條件:G→H___。
(3)寫出B→C化學反應方程式:___;
(4)寫出E+F→N化學反應方程式:___。
(5)H在一定條件下能被氧化為不飽和酸![]() ,該不飽和酸有多種同分異構體,屬于酯類且含有碳碳雙鍵的同分異構體共有___種。
,該不飽和酸有多種同分異構體,屬于酯類且含有碳碳雙鍵的同分異構體共有___種。
(6)已知:①RCHO![]()
![]()
②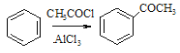
③![]() +SOCl2
+SOCl2![]() +SO2+HCl
+SO2+HCl
根據已有知識并結合相關信息,寫出以 為原料制備
為原料制備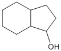 的合成路線流程圖(無機試劑任用)___。合成路線流程圖示例如下:H2C=CH2
的合成路線流程圖(無機試劑任用)___。合成路線流程圖示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH。
CH3CH2OH。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用硫酸亞鐵銨[(NH4)2Fe(SO4)2·6H2O]滴定法測定鉻鐵礦中鉻含量的過程如下:
酸溶:準確稱取0.1950 g鉻鐵礦試樣放入錐形瓶中,加入適量磷酸和硫酸的混合酸,加熱使試樣完全溶解,冷卻。
氧化:向上述溶液中滴加5滴1%的MnSO4溶液,再加入一定量的過硫酸銨[(NH4)2S2O8]溶液,搖勻,加熱煮沸至出現紫紅色,繼續加熱煮沸至紫紅色褪去,冷卻。[已知:①2Mn2+ + 5S2O82- + 8H2O = 10SO42- + 2MnO4- + 16H+;②繼續加熱煮沸后,溶液中過量(NH4)2S2O8和生成的HMnO4已分解除去]
滴定:用0.2050mol·L-1(NH4)2Fe(SO4)2標準溶液滴定上述溶液至終點,消耗19.50 mL標準溶液。(已知:Cr2O72-![]() Cr3+)
Cr3+)
(1)過硫酸銨保存在棕色試劑瓶中的原因是___________。
(2)①“氧化”的目的是將試樣溶液中的Cr3+氧化成Cr2O72-,加入5滴MnSO4溶液的目的是________________(已知該條件下還原性:Cr3+ > Mn2+)。
②“氧化”過程中,如果繼續加熱煮沸時間不充足,會使鉻含量的測定結果______(填“偏大”“不變”或“偏小”)。
(3)計算鉻鐵礦中鉻的質量分數(寫出計算過程)。___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com