
【題目】執法交警最常用的一種酒精檢測儀的工作原理示意圖如圖所示,其反應原理為CH3CH2OH+O2=CH3COOH+H2O,被測者呼出氣體中所含的酒精被輸送到電池中反應產生微小電流,該電流經電子放大器放大后在液晶顯示屏上顯示其酒精含量。下列說法正確的是( )
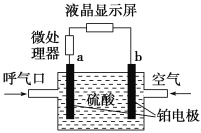
A.呼出氣體中酒精含量越高,微處理器中通過的電流越小
B.電解質溶液中的H+移向a電極
C.b為正極,電極反應式為O2+2H2O+4e-=4OH-
D.a極上的電極反應式為CH3CH2OH+H2O-4e-=CH3COOH+4H+
 全能測控一本好卷系列答案
全能測控一本好卷系列答案科目:高中化學 來源: 題型:
【題目】據研究報道,藥物瑞德西韋(Remdesivir)對2019年新型冠狀病毒(COVID—19)有明顯抑制作用。K為藥物合成的中間體,其合成路線如圖:
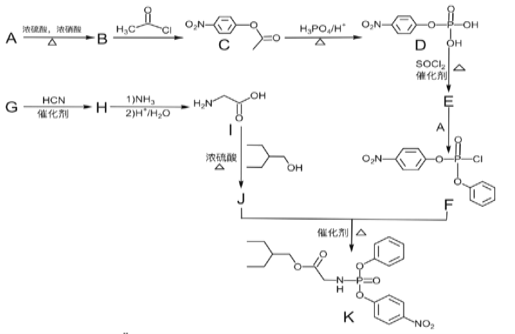
已知:(1)R—OH![]() R—Cl
R—Cl
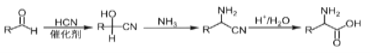
(2)
回答下列問題:
(1)B的化學名稱為__。
(2)J中含氧官能團的名稱為__。
(3)B到C的反應類型是___,G到H的反應類型是__。
(4)由G生成H的化學反應方程式為___。
(5)E中含兩個Cl原子,則E的結構簡式___。
(6)X是C同分異構體,寫出滿足下列條件的X的結構簡式___。
①苯環上含有硝基且苯環上只有一種氫原子;②遇FeCl3溶液發生顯色反應;③1mol的X與足量金屬Na反應可生成2gH2。
(7)參照F的合成路線圖,設計由![]() 、SOCl2為原料制備
、SOCl2為原料制備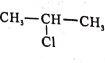 的合成路線(無機試劑任選)___。
的合成路線(無機試劑任選)___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素R、X、T、Z、Q在元素周期表中的相對位置如下表所示,其中R單質在暗處與H2劇烈化合并發生爆炸。則下列判斷正確的是
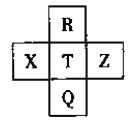
A. 非金屬性:Z<T<X
B. R與Q的電子數相差26
C. 氣態氫化物穩定性:R<T<Q
D. 最高價氧化物的水化物的酸性:Q>T
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硼(BN)是一種重要的功能陶瓷材料以天然硼砂為起始物,經過一系列反應可以得到BF3和BN,如圖所示:
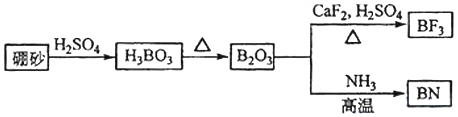
請回答下列問題:
(1)寫出B2O3與NH3反應生成BN的化學反應方程式______________
(2)基態N原子的價層電子排布式為________。
(3)B、N、O相比,第一電離能最大的是______,BN中B元素的化合價為_____
(4)寫出一個與SO42﹣互為等電子體的微粒__________。
(5)BF3能與NH3反應生成BF3NH3,BF3NH3中BF3與NH3之間通過________(填“離子鍵”、“配位鍵”或“氫鍵”) 結合。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把0.4molX氣體和0.6molY氣體混合于2L密閉容器中,使它們發生如下反應:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若測知以Z的濃度變化表示的反應速率為0.05mol/(L·min),試計算
nZ(g)+6W(g)。2min末已生成0.3molW,若測知以Z的濃度變化表示的反應速率為0.05mol/(L·min),試計算
(1)前2min內用W的濃度變化表示的平均反應速率為_______________。
(2)2min末時Y的濃度為_____________________________。
(3)化學反應方程式中n=_____________________________。
(4)2min末,恢復到反應前溫度,體系內壓強是反應前壓強的__________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)乙醇是未來內燃機的首選環保型液體燃料。2.0g乙醇完全燃燒生成液態水放出59.43kJ的熱量,則乙醇燃燒的熱化學方程式__。
(2)已知下列熱化學方程式:
①C(s,石墨)+O2(g)═CO2(g) △H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l) △H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H=-2599kJmol-1
請寫出C(s,石墨)和H2(g)生成1mol C2H2(g)的熱化學方程式_____。
(3)已知幾種共價鍵的鍵能數據如下表:
共價鍵 | N≡N | H—H | N—H |
鍵能(kJ/mol) | 946 | 436 | 390.8 |
寫出合成氨反應的熱化學方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列實驗所選擇的裝置或儀器(夾持裝置已略去)正確的是( )
A | B | C | D | |
實驗 | 制取少量純凈的CO2氣體 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl飽和溶液制備NaCl晶體 |
裝置或儀器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池是化學電源,其電極材料分別是Pb和PbO2,電解液為稀硫酸。工作時該電池總反應式為:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根據上述情況判斷:
2PbSO4(s)+2H2O(l)。根據上述情況判斷:
(1)放電時,電解質溶液的pH________(填“增大”“減小”或“不變”)。
(2)放電時,電解質溶液中陰離子移向_____極,電子從_____極流向____極。
(3)寫出負極的電極方程式:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醛(HCHO)是一種重要的化工產品,工業上可用甲醇脫氫法制備,相關反應方程式為:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列問題:
HCHO(g)+H2(g) △H=+akJ/mol回答下列問題:
(1)反應過程中需要向體系中通入空氣,通過以下反應提供上述反應所需要的熱量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反應溫度維持在650℃,則進料時,甲醇和空氣的體積比應為___(已知空氣中氧氣的體積分數為20%,b>a)。
(2)Na2CO3是甲醇脫氫制甲醛的催化劑,有研究指出,催化反應的部分機理如下:
歷程i:CH30H→H+CH2OH(H叫做氫自由基,實際上就是H原子,有很高的反應活性,
“”代表有一個單電子可以參與配對成鍵)
歷程ii:CH2OH→H+HCHO
歷程iii:CH2OH→3H+CO
歷程iv:自由基發生碰撞形成新化學鍵而湮滅
如圖1所示為在體積為2L的恒容容器中,投入1molCH3OH(g),在碳酸鈉催化劑作用下開始反應,20min后,測得甲醇的轉化率(X)與甲醛的選擇性(S)與溫度的關系(副反應僅考慮CH3OH![]() CO+2H2):
CO+2H2):
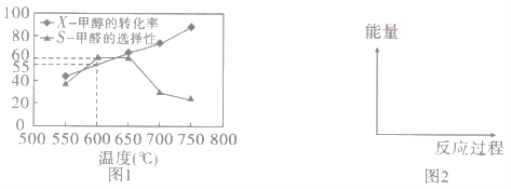
①請在圖2所給坐標中,畫出歷程iv的反應過程一能量變化示意圖___。
②下列說法合理的是__。
a.升高溫度,甲醇轉化率提高,平衡常數變大
b.當體系氣體密度保持不變時,達到平衡狀態
c.及時分離產品有利于提高甲醇生成甲醛的轉化率
③600℃時,前20min甲醇的平均反應速率為__,此時生成甲醛的反應的Qp=___(Qp的表達式與平衡常數Kp相同,p為物質的分壓,分壓=總壓×物質的量分數,體系初始壓強為P0)
④650℃以后,甲醛的選擇性降低,而甲醇的轉化率升高的可能原因是___。
(3)氧化劑可處理甲醛污染,結合以下圖像分析夏季(水溫約20℃)應急處理甲醛污染的水源最好應選擇的試劑為____。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com