
【題目】煤的氣化是煤高效、潔凈利用的方向之一。如圖為加熱某地煤樣所得煤氣組成及體積分數隨溫度變化的曲線圖。由圖可知該煤氣中
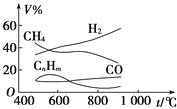
A. 只含有碳、氫兩種元素
B. 所含的有機物是CH4、CnHm
C. CO體積分數大于CH4體積分數
D. 低溫有助于提高H2的含量
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A. △H<0的反應一定能自發反應進行。
B. 對于一個給定的反應,選擇合適的催化劑可以大幅度提升正逆反應速率和反應物轉化率。
C. 鐵與稀硫酸反應制取氫氣,向溶液中加入少量的CuSO4固體可以加快化學反應速率
D. 在恒溫恒壓的密閉容器中進行反應2NO+O2![]() 2NO2,達到平衡后充入He,平衡不移動。
2NO2,達到平衡后充入He,平衡不移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是一種強還原性的堿性液體,常用作火箭燃料。利用尿素法生產水合肼的原理為CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
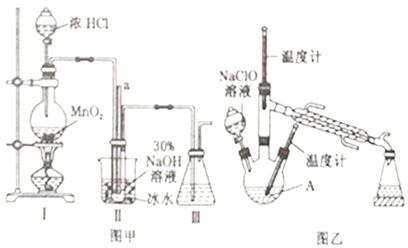
實驗1:制備NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)圖甲裝置Ⅰ中燒瓶內發生反應的離子方程式為________________________。
(2)用NaOH固體配制溶質質量分數為30%的NaOH溶液時,所需玻璃儀器有_______________。
(3)圖甲裝置Ⅱ中用冰水浴控制溫度的目的是________________________。
實驗2:制取水合肼
(4)圖乙中若分液漏斗滴液速度過快,部分N2H4·H2O會參與A 中反應并產生大量氮氣,降低產品產率,該過程中反應生成氮氣的化學方程式為__________________。充分反應后,蒸餾A中溶液即可得到水合肼的粗產品。
實驗3:測定餾分中水合肼的含量
(5)稱取餾分3.0g,加入適量NaHCO3固體(滴定過程中,調節溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于錐形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的標準溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入適量NaHCO3固體,則測量結果會___________“偏大”“ 偏小”“ 無影響”)。
②下列能導致餾分中水合肼的含量測定結果偏高的是___________(填字母)。
a.錐形瓶清洗干凈后未干燥
b.滴定前,滴定管內無氣泡,滴定后有氣泡
c.讀數時,滴定前平視,滴定后俯視
d.盛標準液的滴定管水洗后,直接裝標準液
③實驗測得消耗I2溶液的平均值為20.00mL,餾分中水合肼(N2H4·H2O)的質量分數為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用廢鐵屑制備磁性膠體粒子,制取過程如下:

下列說法不正確的是
A. 用Na2CO3溶液浸泡是為了除去廢鐵屑表面的油污
B. 通入N2是防止空氣中的O2氧化二價鐵元素
C. 加適量的H2O2是為了將部分Fe2+氧化為Fe3+,涉及反應:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的濃度比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組對SO2與漂粉精的反應進行實驗探究:
操作 | 現象 |
取4 g漂粉精固體,加入100 mL水 | 部分固體溶解 |
過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
| i.出現渾濁,溶液變為黃綠色; ⅱ.稍后,產生大量白色沉淀,黃綠色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化學方程式是_________________。
(2)pH試紙顏色的變化說明漂粉精溶液具有的性質是______________________。
(3)甲同學認為現象i中溶液變為黃綠色的可能原因是:隨溶液酸性的增強,漂粉精的有效成分和Cl-發生反應。通過進一步實驗確認了這種可能性,其實驗方案是___________________。
(4)乙同學通過實驗確定了A瓶中大量白色沉淀是CaSO4,并用離子方程式解釋了現象ⅱ中黃綠色褪去的原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016 年諾貝爾化學獎授予在“分子機器設計和合成”領域有突出成就的三位科學家,其研究對象之一“分子開關”即與大環主體分子苯芳烴、硫或氮雜環杯芳烴等有關。回答下列問題:
(1)對叔丁基杯[4]芳烴(如圖Ⅰ所示)可用于ⅢB 族元素對應離子的萃取,如La3+、Sc2+。寫出基態二價 鈧離子(Sc2+)的核外電子排布式:____,其中電子占據的軌道數為_____個。
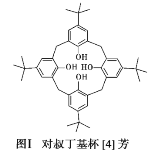
(2)對叔丁基杯[4]芳烴由4個羥基構成杯底,其中羥基氧原子的雜化方式為_____,羥基間的相互作用力為_____。
(3)不同大小苯芳烴能識別某些離子,如:N3-、SCN等。一定條件下,SCN與 MnO2反應可得到(SCN)2,試寫出(SCN)2的結構式_______。
(4)NH3分子在獨立存在時 H-N-H 鍵角為 106.7°。 [Zn(NH3)6]2+離子中 H-N-H 鍵角變為 109.5°,其原因是:_________________________。
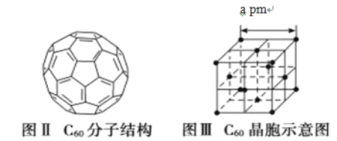
(5)已知 C60 分子結構和 C60 晶胞示意圖(如圖Ⅱ、圖Ⅲ所示):則一個 C60 分子中含有σ鍵的個數為______,C60 晶體密度的計算式為____gcm3。(NA 為阿伏伽德羅常數 的值)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表前三周期的一部分:

(1)判斷 Y ____ Z _____ R _____(寫元素符號)。
(2)寫出X的氫化物的化學式:_________,W的氫化物的化學式_________,其沸點比較: ________>________ ______________ (填化學式)
(3)下圖是X的基態原子的電子排布圖,其中有一個是錯誤的,它不能作為基態原子的電子排布 圖是因為它不符合________。


(4)以上五種元素中,________(填元素符號)元素第一電離能最大。_____元素電負性最大,Y的基態原子的電子排布式為________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、M、X、Y、Z是周期表前36號元素中的四種常見元素,其原子序數依次增大。W的一種核素在考古時常用來鑒定一些文物的年代;M的氧化物是導致酸雨的主要物質之一。X的某一種單質是大氣污染物監測物之一;Y的基態原子核外有6個原子軌道處于半充滿狀態;Z能形成紅色的Z2O和黑色的ZO兩種氧化物。
(1)Y3+基態的電子排布式可表示為 。
(2)MX3-的空間構型 (用文字描述)。
(3)M可形成多種氫化物,其中MH3的堿性強于M2H4的原因是 。
(4)根據等電子原理,WX分子的結構式為 。
(5)1 mol WX2中含有的σ鍵數目為 。
(6)H2X分子中X原子軌道的雜化類型為 。
(7)向Z2+的溶液中加入過量NaOH溶液,可生成Z的配位數為4的配位離子,寫出該配位離子的結構式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置中:b電極用金屬M制成,a、c、d為石墨電極,接通電源,金屬M沉積于b極,同時a、d電極上產生氣泡。試回答
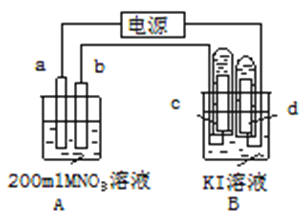
(1)a連接電源的__________極。b極的電極反應式為______________________________。
(2)電解開始時,在B燒杯的中央,滴幾滴淀粉溶液,你能觀察到的現象是:_______________,電解進行一段時間后,罩在C極上的試管中也收集到了氣體。此時C極上的電極反應式為________________________________
(3)當d極上收集到44.8mL氣體(標準狀況)時停止電解,a極上放出了__________mol氣體,若在b電極上沉積金屬M的質量為0.432g,則此金屬的摩爾質量為___________。
(4)電解停止后加蒸餾水使A燒杯中的溶液體積仍為200mL。取該溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,當加入25.00mL這種溶液時剛好沉淀完全。試計算電解前A燒杯中MNO3溶液的物質的量濃度為__________mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com