
Fe2O3具有廣泛的用途。
甲同學閱讀有關資料得知:在高溫下煅燒FeCO3 可以得到Fe2O3。為了進一步驗證此結論,他做了如下實驗:
| 實驗步驟 | 實驗操作 |
| Ⅰ | 取一定質量的FeCO3固體置于坩堝中,高溫煅燒至質量不再減輕,冷卻至室溫。 |
| Ⅱ | 取少量實驗步驟Ⅰ所得固體放于一潔凈的試管中,用足量的稀硫酸溶解。 |
| Ⅲ | 向實驗步驟Ⅱ所得溶液中滴加KSCN溶液,溶液變紅。 |
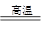 2Fe2O3+4CO2
2Fe2O3+4CO2科目:高中化學 來源: 題型:實驗題
一位學生對鐵與氧化鐵反應后的產物進行探究。
(1)提出假設
假設1:產物為FeO;
假設2:__________________。
(2)查閱資料
該學生通過查閱資料得知:在鐵的三種氧化物中,四氧化三鐵最穩定,氧化亞鐵最不穩定,常溫下極易被氧氣氧化成氧化鐵(顏色由黑色變成紅色)。
通過查閱資料可以得出的初步結論為_________________________________。
(3)進行實驗
該學生設計了如下裝置進行鐵與氧化鐵反應的實驗。請你幫助他將實驗步驟補充完整。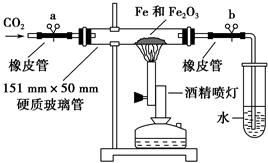
按如圖裝置連接好儀器(暫不裝入藥品),___________________ ____。
②稱取1 g還原性鐵粉和5 g氧化鐵粉末,混合均勻后平攤在玻璃管中部。
③松開兩個彈簧夾,_______________________________________________,
即可夾上彈簧夾a,并開始加熱藥品。
④大約4分鐘左右,棕色粉末全部變黑;再夾上彈簧夾b,然后停止加熱,等到玻璃管冷卻至室溫,倒出黑色粉末。
(4)現提供如下藥品,驗證實驗得到的黑色粉末的成分。磁鐵、稀鹽酸、KSCN溶液、酸性KMnO4溶液、試管、膠頭滴管。
| 實驗步驟 | 預期現象和結論 |
| | |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
鐵銅單質及其化合物的應用范圍很廣。現有含氯化亞鐵雜質的氯化銅晶體(CuCl2·2H2O),為制取純凈的CuCl2·2H2O,首先將其制成水溶液,然后按照如圖步驟進行提純: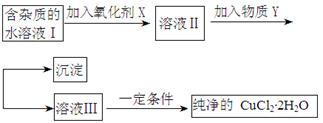
已知Cu2+、Fe3+和Fe2+的氫氧化物開始沉淀和沉淀完全時的pH見下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 氫氧化物沉淀完全時的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
鎂在高溫下與O2、N2或CO2均可以發生反應,試解決下列問題。
(1)工業通常采用電解熔融氯化鎂冶煉金屬鎂,不以氧化鎂為原料的理由是 。
(2)將燃著的鎂條伸入盛滿CO2的集氣瓶中,鎂條劇烈燃燒,發出耀眼的白光,瓶內壁上有黑色物質生成,化學方程式為 。
(3)由金紅石(TiO2)制取單質鈦(Ti),涉及到的反應步驟為
金屬鎂的作用為 ,在Ar氣氛中的進行的理由是 。
(4)現擬在實驗室里利用空氣和鎂粉為原料制取少量氮化鎂(Mg3N2)。已知:
Mg+H2O MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供選擇的裝置和藥品如下圖所示。
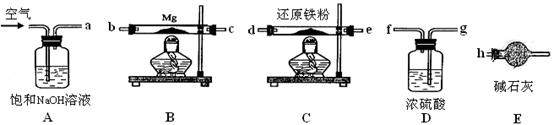
①導管口間的連接次序是:a →( )()→()()→()()→ h
②通氣后,應先點燃 (填“B”或“C”)裝置的酒精燈,裝置A的作用是 ,裝置E的作用是 。
③請設計一個簡單的小實驗驗證產物是氮化鎂 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某同學欲在實驗室中完成Fe與水蒸氣反應的實驗,裝置如圖甲、乙兩種。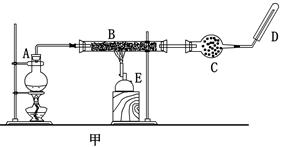
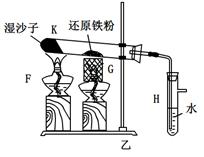
已知:B中放入的是鐵與石棉絨的混合物,C中放的是干燥劑,E為酒精噴燈,G為帶有鐵絲網罩的酒
精燈。對比兩裝置,回答下列問題:
(1)如何檢查乙裝置的氣密性: 。
(2)乙裝置中濕沙子的作用是: 。
(3)B處發生反應的化學方程式: 。
(4)稱取mg鐵粉與適量石棉絨混合,然后加熱至無氣體放出。若收集的氣體體積換算為標準狀況為VL,鐵粉的轉化率為 (列出計算式即可,不必化簡)。
(5)為了證明反應后的固體混合物中含有+3價的Fe,該同學取出少量混合物于試管中,加入一定量的鹽酸使固體混合物溶解,過濾,立即向濾液中滴加KSCN溶液,結果觀察到溶液的顏色沒變化。經過思考,該同學認為此現象不能說明反應后的固體混合物中不含有+3價Fe。他的理由是: _。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(10分)某氯化鐵樣品含有FeCl2雜質。現要測定其中鐵元素的質量分數,實驗按以下步驟進行: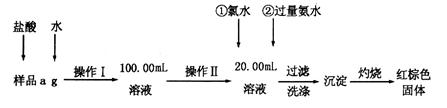
(1)操作I所用到的玻璃儀器除燒杯、玻璃棒外,還必須有________________________(填儀器名稱)。
(2)寫出加入氯水發生反應的離子方程式____________________。
(3)檢驗沉淀已經洗滌干凈的操作及現象是______________________________________
___________________________________________________________________________。
(4)坩堝質量為W1g,加熱后坩堝與紅棕色固體總質量為W2g,則樣品中鐵元素的質量分數是____________________(列出原始算式,不需化簡);若稱量準確而最終測量的結果偏大,則造成誤差的原因可能是_____________________(寫出一種原因即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
人教版《必修1》關于Fe3+和Fe2+的轉化的實驗探究,某校教師為了檢驗學生完成每個實驗過程時相應的問題解決思路,特設計一份化學探究學習“過程-思路”問卷。
(1)請在下表中右欄填寫設計每一步操作過程的思路
| 過程 | 思路 |
| 1.提出假設:Fe2+具有還原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被還原成Fe2+ | ①根據氧化還原反應原理,一般 物質有還原性, 物質有氧化性 |
| 2.設計實驗1:取少量FeCl2溶液,滴加幾滴H2O2溶液,再向溶液中滴加幾滴KSCN溶液,觀察溶液是否變血紅色 | ②用離子方程式表示選擇H2O2的原因 ③用離子方程式表示溶液變血紅色的原因 |
| 3.設計實驗2:取少量FeCl3固體于一試管,用已煮沸的蒸餾水溶解,滴加幾滴KSCN溶液后迅速加入少量鐵粉,蓋上試管塞,觀察溶液的血紅色是否褪去 | ④選擇鐵粉的原因是 (用化學方程式表示) ⑤為什么要用煮沸的水 |
| 4.實施實驗 | …… |
| …… | …… |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
利用酸解法制鈦白粉產生的廢液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4 ],生產硫酸亞鐵和補血劑乳酸亞鐵。其生產步驟如下: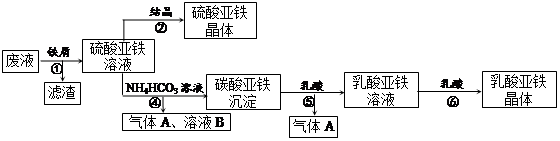
請回答:
(1)步驟①中分離操作的名稱是_______;步驟⑥必須控制一定的真空度,原因是______________
(2)廢液中的TiOSO4在步驟①能水解生成濾渣(主要成分為TiO2?xH2O)的化學方程式為_________
_ ;步驟④的離子方程式為____________________________________。
(3)用平衡移動原理解釋步驟⑤中加乳酸能得到乳酸亞鐵的原因______________________________。
(4)配平酸性高錳酸鉀溶液與硫酸亞鐵溶液反應的離子方程式:
_____ Fe2+ + _____ MnO4- + _____ H+ = _____Fe3+ +_____ Mn2+ +_____
取步驟②所得晶體樣品a g,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(雜質與KMnO4不反應)。若消耗0.1000 mol·L-1 KMnO4溶液20.00mL,則所得晶體中FeSO4? 7H2O的質量分數為(以含a的式子表示) _____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com