
【題目】定條件下存在反應:H2(g)+I2(g) ![]() 2HI(g) △H<0.現有三個相同的1L恒容絕熱(與外界沒有熱量交換)態閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃條件下開始反應。達到平衡時,下列說法正確的是()
2HI(g) △H<0.現有三個相同的1L恒容絕熱(與外界沒有熱量交換)態閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃條件下開始反應。達到平衡時,下列說法正確的是()
A. 容器Ⅰ、Ⅱ中反應速率相同
B. 容器Ⅰ、Ⅲ中反應的平衡常數相同
C. 容器Ⅰ中的氣體顏色比容器Ⅱ中的氣體顏色淺
D. 容器Ⅰ中H2的轉化率與容器Ⅱ中HI的轉化之和小于1
【答案】D
【解析】
A.容器Ⅰ中從正反應開始到達平衡,容器Ⅱ中從逆反應開始到達,平衡建立的途徑不相同;
B.容器Ⅲ中相當于在容器Ⅰ中平衡的基礎上再加入1mol H2和1mol I2(g),反應向正反應進行,故容器Ⅲ中到達平衡時溫度更高,該反應正反應是放熱反應,溫度越高平衡常數越小;
C.容器Ⅱ中所到達的平衡狀態,相當于在容器Ⅰ中平衡的基礎上降低溫度,平衡向正反應移動;
D.溫度相同時,容器Ⅰ中H2 的轉化率與容器Ⅱ中HI的轉化率之和等于1,容器Ⅱ中所到達的平衡狀態,相當于在容器Ⅰ中平衡的基礎上降低溫度,平衡向正反應移動。
A.容器Ⅰ中從正反應開始到達平衡,容器Ⅱ中從逆反應開始到達,平衡建立的途徑不相同,無法比較反應速率,選項A錯誤;
B.容器Ⅲ中相當于在容器Ⅰ中平衡的基礎上再加入1mol H2和1mol I2(g),反應向正反應進行,故容器Ⅲ中到達平衡時溫度更高,該反應正反應是放熱反應,溫度越高平衡常數越小,選項B錯誤;
C.容器Ⅱ中所到達的平衡狀態,相當于在容器Ⅰ中平衡的基礎上降低溫度,平衡向正反應移動,故容器Ⅰ中的氣體顏色比容器Ⅱ中的氣體顏色深,選項C錯誤;
D.溫度相同時,容器I中H2 的轉化率與容器Ⅱ中HI的轉化率之和等于1,容器Ⅱ中所到達的平衡狀態,相當于在容器Ⅰ中平衡的基礎上降低溫度,平衡向正反應移動,HI的轉化率比兩容器相同溫度時容器Ⅱ中HI的轉化率低,故容器Ⅰ中H2 的轉化率與容器Ⅱ中HI的轉化率之和小于1,選項D正確;
答案選D。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:
【題目】測定![]() 溶液先升溫再降溫過程中的
溶液先升溫再降溫過程中的![]() ,數據如下表。實驗過程中,取①、④時刻的溶液,加入鹽酸酸化的
,數據如下表。實驗過程中,取①、④時刻的溶液,加入鹽酸酸化的![]() 溶液做對比實驗,④產生白色沉淀多。下列說法不正確的是
溶液做對比實驗,④產生白色沉淀多。下列說法不正確的是
時刻 | ① | ② | ③ | ④ |
溫度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④產生的白色沉淀是![]()
C. ①→③的過程中,![]() 在降低
在降低
D. ①→③的過程中,溫度與![]() 相比,前者對水解平衡的影響更大
相比,前者對水解平衡的影響更大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三種常見元素結構信息如下表,試根據信息回答有關問題:

(1)寫出B原子的基態電子排布式__;
(2)用氫鍵表示式寫出A的氫化物溶液中存在的氫鍵__(任寫一種);A的氫化物分子結合一個H+形成陽離子后,其鍵角__(填寫“變大”、“變小”、“不變”);
(3)往C元素的硫酸鹽溶液中逐滴加入過量A元素的氫化物水溶液,可生成的配合物的化學式為__,簡要描述該配合物中化學鍵的成鍵情況__;
(4)下列分子結構圖中的“●”表示上述相關元素的原子中除去最外層電子的剩余部分,“○”表示氫原子,小黑點“”表示沒有形成共價鍵的最外層電子,短線表示共價鍵.

在以上分子中,中心原子采用sp3雜化形成化學鍵是__(填寫序號);在②的分子中有__個σ鍵和__個π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位鍵
和[Cu(NH3)4]2+中都存在配位鍵
B. 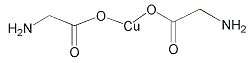 σ鍵和π鍵比例為7:1
σ鍵和π鍵比例為7:1
C. C![]() 與O
與O![]() 互為等電子體,1 mol O
互為等電子體,1 mol O![]() 中含有的π鍵數目為2NA
中含有的π鍵數目為2NA
D. 已知反應N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若該反應中有4 mol N—H鍵斷裂,則形成的π鍵數目為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、R、W是原子序數依次遞增的五種短周期主族元素,它們所在周期數之和為11,其中Y元素最高與最低化合價的代數和為2,Y和Z的單質生成的化合物是一種傳遞神經信息的“信使分子”,R的原子半徑是五種元素中最大的,Y和W是同族元素。下列說法錯誤的是( )
A. 簡單離子的還原性:Y>Z
B. R的單質可能是金屬或非金屬
C. 由X、Z和W構成的酸一定是三元酸
D. 標準狀況下,1molYZ與0.5mol![]() 混合后所得氣體的體積一定小于22.4L
混合后所得氣體的體積一定小于22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)2017年中科院某研究團隊通過設計一種新型Na-Fe3O4/HZSM-5多功能復合催化劑,成功實現了CO2直接加氫制取辛烷值汽油,該研究成果被評價為“CO2催化轉化領域的突破性進展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
試寫出25℃、101kPa條件下,CO2與H2反應生成汽油(以C8H18表示)的熱化學方程式_________________________________。
(2)利用CO2及H2為原料,在合適的催化劑(如Cu/ZnO催化劑)作用下,也可合成CH3OH,涉及的反應有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常數K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常數K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常數K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常數K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常數K=______(用含K1、K2的表達式表示),該反應△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常數K=______(用含K1、K2的表達式表示),該反應△H_____0(填“大于”或“小于”)。
②提高CO2轉化為CH3OH平衡轉化率的措施有___________(填寫兩項)。
③催化劑和反應體系的關系就像鎖和鑰匙的關系一樣,具有高度的選擇性。下列四組實驗,控制CO2和H2初始投料比均為1:2.2,經過相同反應時間(t1min)。
溫度(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) | 綜合選項 |
543 | Cu/ZnO納米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO納米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO納米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO納米片材料 | 12.0 | 70.6 | D |
由表格中的數據可知,相同溫度下不同的催化劑對CO2的轉化為CH3OH的選擇性有顯著影響,根據上表所給數據結合反應原理,所得最優選項為___________(填字母符號)。
(3)以CO、H2為原料合成甲醇的反應為:CO(g)+2H2(g)![]() CH3OH(g)。在體積均為2L的三個恒容密閉容器Ⅰ、Ⅱ、Ⅲ中,分別都充入1molCO和2molH2,三個容器的反應溫度分別為T1、T2、T3且恒定不變。下圖為三個容器中的反應均進行到5min時H2的體積分數示意圖,其中有一個容器反應一定達到平衡狀態。
CH3OH(g)。在體積均為2L的三個恒容密閉容器Ⅰ、Ⅱ、Ⅲ中,分別都充入1molCO和2molH2,三個容器的反應溫度分別為T1、T2、T3且恒定不變。下圖為三個容器中的反應均進行到5min時H2的體積分數示意圖,其中有一個容器反應一定達到平衡狀態。
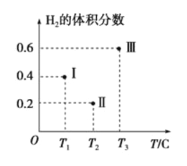
①0~5min時間內容器Ⅱ中用CH3OH表示的化學反應速率為_________________。
②三個容器中一定達到平衡狀態的是容器________(填寫容器代號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究含N、S的污染排放物并妥善處理和利用,意義重大。回答下列問題:
(1)![]() 尾氣先用氨水吸收生成
尾氣先用氨水吸收生成![]() ,反應為
,反應為![]()
![]() ,再將
,再將![]() 氧化為
氧化為![]() ,最終實現副產氮肥,變廢為寶。兩種氧化方案如下:
,最終實現副產氮肥,變廢為寶。兩種氧化方案如下:
方案1:![]()
方案2:![]() ,
,
![]() 。
。
30℃時,分別向兩相同容器中加入100L 0.4![]() 溶液,加入足量相同物質的量的氧化劑,測得
溶液,加入足量相同物質的量的氧化劑,測得![]() 的氧化率X(%)隨時間的變化如圖所示。
的氧化率X(%)隨時間的變化如圖所示。
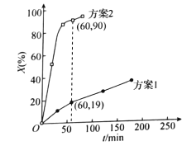
據上述圖像判斷,氧化![]() 為
為![]() 的能力是
的能力是![]() ____(填“大于”或“小于”)
____(填“大于”或“小于”)![]() ,可能的原因是___。
,可能的原因是___。
②60min內測得方案2體系中用![]() 表示的反應速率為__
表示的反應速率為__![]() 。
。
(2)方案2中,![]() 會被氧化成
會被氧化成![]() ,而
,而![]() 不能結合氧氣(活化分子氧),為了保持鈷氨溶液的吸收能力,需添加
不能結合氧氣(活化分子氧),為了保持鈷氨溶液的吸收能力,需添加![]() 將
將![]() 還原成
還原成![]() ,同時生成
,同時生成![]() 。反應歷程如下:
。反應歷程如下:
i:![]()
ii:_____
iii:![]()
iv:![]()
則第ii步反應為____。
(3)利用廢氣中的![]() 將(2)中生成的
將(2)中生成的![]() 還原成
還原成![]() ,以實現
,以實現![]() 再生。反應的離子方程式為____。
再生。反應的離子方程式為____。
![]() 再生后,實現了利用方案2完整地氧化
再生后,實現了利用方案2完整地氧化![]() 為
為![]() 的過程,則整個過程中起催化劑作用的是___(填離子符號)。
的過程,則整個過程中起催化劑作用的是___(填離子符號)。
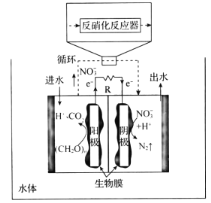
(4)關于微生物電化學系統處理含氮廢水的研究快速發展,如圖是一種新型的浸沒式雙極室脫鹽-反硝化電池。由陽極室和陰極室組成,中間由質子交換膜隔開,陽極室中的有機物則被微生物氧化降解產生電子和質子,其中的![]() 通過泵循環至陰極室,經過反硝化反應器中反硝化菌的作用被還原成
通過泵循環至陰極室,經過反硝化反應器中反硝化菌的作用被還原成![]() 。
。
①微生物電化學系統處理有機含氮廢水的優點是____。
②寫出負極發生反應的電極反應式:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. FeCl3溶液中滴加過量Na2S溶液:2Fe3++S2- =2Fe2++S↓
B. 將Na2O2固體投入H218O中:2Na2O2+2H218O =4Na++4OH-+18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 二氧化錳與濃鹽酸反應:MnO2+4H++4Cl- ![]() Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數,下列說法正確的是( )
A.標準狀況下,22.4 L CO和CO2的混合氣體中所含的碳原子數一定是NA
B.標準狀況下,2.24L氯氣溶于水發生反應,轉移的電子數目為0.1 NA
C.物質的量濃度為2mol/L的BaCl2溶液中,含有Cl-個數為4NA
D.標準狀況下,11.2L H2O含有0.5NA分子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com