
【題目】Ⅰ.某實驗小組對H2O2的分解做了如下探究,將質量相同的粉末狀和塊狀的MnO2分別加入盛有15 mL5%的H2O2溶液的大試管中,并用帶火星的木條測試,下表是該實驗小組研究影響H2O2分解速率的因素時記錄的一組數據。
MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5 min |
塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30 min |
(1)寫出大試管中發生反應的化學方程式:______。該反應是______(填“放熱”或“吸熱”)反應。
(2)實驗結果表明,催化劑的催化效果與____有關。
(3)某同學在10 mLH2O2溶液中加入一定量的MnO2,放出氣體的體積(標準狀況)與反應時間的關系如下圖所示,則A、B、C三點所表示的反應速率最慢的是____。

Ⅱ.某反應在體積為5 L的恒容密閉容器中進行,在0~3分鐘內各物質的量的變化情況如下圖所示(A,B,C均為氣體)。

(4)該反應的化學方程式為____。
(5)反應開始至2分鐘時,B的平均反應速率為_____,A的轉化率為______。
【答案】2H2O2![]() 2H2O +O2↑ 放熱 催化劑接觸面積的大小 C 2A+B
2H2O +O2↑ 放熱 催化劑接觸面積的大小 C 2A+B![]() 2C 0.1 mol/(L·min) 40%
2C 0.1 mol/(L·min) 40%
【解析】
Ⅰ.(1)二氧化錳是過氧化氫分解的催化劑,由帶火星木條復燃,可知產物,由此可寫出方程式,反應發生后溶液溫度升高,說明反應為放熱反應;
(2)由實驗現象可知催化劑作用大小的影響因素;
(3)A、B、C三點的斜率代表反應速率,斜率越大,反應速率越大;
Ⅱ.(4)從物質的物質的量的變化趨勢判斷反應物和生成物,根據物質的物質的量變化值等于化學計量數之比書寫化學方程;
(5)化學反應速率是單位時間內濃度的變化,據此可求得反應速率;利用轉化率等于轉化量與起始量的比值計算物質的平衡轉化率。
I.(1)上述實驗中發生反應的化學方程式為:2H2O2![]() 2H2O +O2↑,反應發生后物質溫度升高,說明H2O2的分解反應為放熱反應;
2H2O +O2↑,反應發生后物質溫度升高,說明H2O2的分解反應為放熱反應;
(2)反應時間少,則反應速率快,實驗結果表明,催化劑的催化效果與催化劑的表面積有關;
(3)由圖可知,曲線斜率變小,反應速率減小,則A、B、C三點所表示的反應速率最慢的是C;
Ⅱ.(4)由圖象可知:A、B的物質的量逐漸減小,則A、B為反應物,C的物質的量逐漸增多,則C為生成物,當反應到達2 min時,△n(A)=2 mol,△n(B)=1 mol,△n(C)=2 mol,在化學反應中,各物質的物質的量的變化值與化學計量數呈正比,則△n(A):△n(B):△n(C)=2:1:2,2 min后外界條件不變,三種物質都存在,且各種物質的物質的量都不發生變化,說明該反應為可逆反應,故反應的化學方程式為:2A+B![]() 2C;
2C;
(5)由圖象可以看出,反應開始至2分鐘時,△n(B)=1 mol,B的平均反應速率v(B)=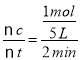 =0.1 mol/(L·min);2 min內A改變的物質的量為△n(A)=2 mol,反應開始時A物質的量是5 mol,所以A的反應轉化率為
=0.1 mol/(L·min);2 min內A改變的物質的量為△n(A)=2 mol,反應開始時A物質的量是5 mol,所以A的反應轉化率為![]() ×100%=40%。
×100%=40%。


科目:高中化學 來源: 題型:
【題目】實驗室用下圖所示的裝置制取乙酸乙酯
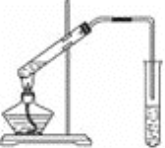
(1)在大試管中加入碎瓷片然后配制一定比例的乙醇、乙酸和濃硫酸的混合液,然后輕輕振蕩試管使之混合均勻,加入碎瓷片的目的的________。
(2)裝置中通蒸氣的導管要插在飽和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)圖中右邊試管中試劑是_________________。作用是①__________________②_______________________________③____________________________。
(4)分離得到乙酸乙酯的方法是____________,分離需要的玻璃儀器是______________________。
(5)寫出制乙酸乙酯的方程式____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用零價鐵(Fe)去除水體中的硝酸鹽(NO3-)已成為環境修復研究的熱點之一。
(1)Fe還原水體中NO3-的反應原理如圖所示。
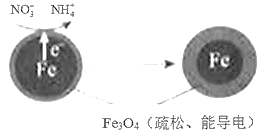
①作負極的物質是____。
②正極的電極反應式是____。
(2)將足量鐵粉投入水體中,經24小時測定NO3-的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小時pH | 接近中性 | 接近中性 |
鐵的最終物質形態 |
|
|
pH=4.5時,NO3-的去除率低。其原因是____。
(4)其他條件與(2)相同,經1小時測定NO3-的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 約10% | 約3% |
1小時pH | 接近中性 | 接近中性 |
與(2)中數據對比,解釋(2)中初始pH不同時,NO3-去除率和鐵的最終物質形態不同的原因:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在家期間設計了如下實驗驗證家中常見的兩種有機物性質,請根據題目要求填寫下列空格:
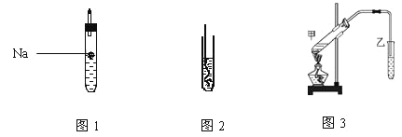
(1)如圖1所示,試管中裝乙醇產生反應的方程式_____ ,該反應類型為____ ;
(2)如圖2所示,螺旋狀的銅絲加熱后可以銅絲表面變成______色,插入到裝有乙醇的試管中銅絲表面又變成___色,并聞到有刺激性氣味,該物質的結構簡式為__;
(3)將雞蛋放入食醋中看到雞蛋表面有氣泡生成,說明醋酸的酸性_____碳酸的酸性。(填“強于”或“弱于”)
(4)按如圖3所示裝置,甲試管中裝有乙酸、乙醇、濃硫酸還需要加入____,目的是_______;加熱時發生的反應方程式為__________,一段時間后在裝有飽和碳酸鈉溶液的乙試管______(填“上方”或“下方”)可以看到油狀物質并聞到有特殊香味,分離該物質的實驗操作是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組查閱資料得知:保險粉(Na2S2O4)和KOH的混合溶液能定量吸收O2;CuCl的鹽酸溶液能定量吸收CO,且易被O2氧化。擬設計實驗方案,采用上述兩種溶液和KOH溶液及量氣裝置,測定高爐煤氣中CO、CO2、N2和O2的百分組成。下列說法不正確的是( )
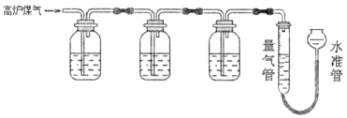
A.采用上述3種吸收劑,氣體被逐一吸收的順序應該是CO2、O2和CO
B.保險粉(Na2S2O4)和KOH的混合溶液吸收O2的離子方程式為2S2O42-+3O2+4OH-=4SO42-+2H2O
C.當三種氣體被逐一吸收后,導出的氣體中可能含有HCl
D.其他兩種吸收劑不變,O2的吸收劑可以用灼熱的銅網替代
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在;鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中制取高純碳酸鈷(CoCO3)的工藝流程如圖:
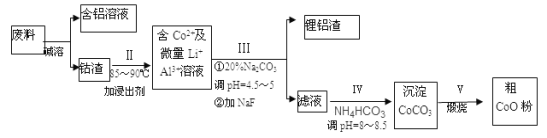
(1)寫出一條加快堿溶速率的措施__。
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的離子反應方程式為__(產物中只有一種酸根)。該過程不能用鹽酸代替硫酸進行酸化,原因是_。
(3)過程Ⅲ中碳酸鈉溶液的作用是沉淀Al3+和Li+,寫出沉淀Al3+的離子方程式__。
(4)過程Ⅳ沉鈷的離子方程式是__。
(5)CoCO3可用于制備鋰離子電池的正極材料LiCoO2,其生產工藝是將n(Li):n(Co)=l:l的Li2CO3和CoCO3的固體混合物在空氣中加熱至700℃~900℃。試寫出該反應的化學方程式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物分子結構式如下圖,下列說法正確的是( )
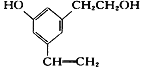
A. 取少量該有機物,滴加酸性高錳酸鉀溶液,微熱,有氣體產生
B. 所有的碳原子不可能處在同一個平面上
C. 所有的氧原子不可能同時處在苯環平面上
D. 所有的氫原子有可能同時處在苯環平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需配制500mL0.2mol/LNaOH溶液,實驗操作步驟為:
A.把制得的溶液小心地轉移至容量瓶中。
B.在天平上稱取 g的氫氧化鈉鈉固體,把它放在燒杯中,用適量的蒸餾水將它完全溶解并冷卻至室溫。
C.繼續向容量瓶中加蒸餾水至 ,改用膠頭滴管小心滴加蒸餾水至溶液凹液面底部與刻度線相切。
D.用少量蒸餾水洗滌燒杯和玻璃棒2~3次,每次洗滌的液體都小心注入容量瓶,并輕輕振蕩。
E.將容量瓶塞塞緊,充分搖勻。
請填寫下列空白:
(1)操作步驟的正確順序為___(填序號)。
(2)題目B、C項空白處填入。___、___。
(3)本實驗用到的基本儀器已有燒杯、天平(砝碼、鑷子)、玻璃棒,還缺少的必要儀器是___。
(4)下列情況中,會使所配溶液濃度偏高的是___(填序號)。
A.沒有冷卻直接移液
B.沒有進行上述的操作步驟D
C.加蒸餾水時,不慎超過了刻度線
D.容量瓶使用前內壁沾有水珠
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】國慶70周年閱兵式展示了我國研制的各種導彈。導彈之所以有神奇的命中率,與材料息息相關,鎵(Ga)、鍺(Ge)、硅(Si)、硒(Se)的單質及某些化合物(如砷化鎵、磷化鎵等)都是常用的半導體材料。回答下列問題:
(1)硒常用作光敏材料,基態硒原子的核外電子排布式為[Ar]__。
(2)根據元素周期律,原子半徑Ga__As,第一電離能Ga__As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位數是__。
(4)GaN、GaP、GaAs都是很好的半導體材料,晶體類型與晶體硅類似,熔點如下表所示,分析其變化原因:__。
晶體 | GaN | GaP | GaAs |
熔點/℃ | 1700 | 1480 | 1238 |
(5)GaN晶胞的結構如圖1所示。已知六棱柱底邊邊長為acm,阿伏加德羅常數的值為NA。
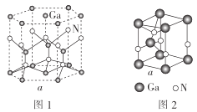
①晶胞中Ga原子采用六方最密堆積方式,每個Ga原子周圍距離最近的Ga原子數目為__。
②從GaN晶體中“分割”出的平行六面體如圖2。若該平行六面體的體積為![]() a3cm3,則GaN晶體的密度為__(用含a、NA的代數式表示)g·cm-3。
a3cm3,則GaN晶體的密度為__(用含a、NA的代數式表示)g·cm-3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com