
【題目】隨原子序數的遞增,九種短周期元素![]() 用字母表示
用字母表示![]() 原子半徑的相對大小、最高正價或最低負價的變化如圖所示.
原子半徑的相對大小、最高正價或最低負價的變化如圖所示.

請回答下列問題;
![]() 、d、e、f四種元素的簡單離子中,半徑最大的離子是 ______
、d、e、f四種元素的簡單離子中,半徑最大的離子是 ______ ![]() 填離子符號
填離子符號![]()
![]() 的氫氧化物是一種重要的基本化工原料,寫出工業上制備該氫氧化物的離子方程式 ______ 。
的氫氧化物是一種重要的基本化工原料,寫出工業上制備該氫氧化物的離子方程式 ______ 。
![]() 含f元素的兩種離子在溶液中不能大量共存的原因是 ______
含f元素的兩種離子在溶液中不能大量共存的原因是 ______ ![]() 用離子方程式表示
用離子方程式表示![]()
![]() 關于圖乙所示轉化關系
關于圖乙所示轉化關系![]() 代表鹵素
代表鹵素![]() ,下列說法錯誤的是 ______ 。
,下列說法錯誤的是 ______ 。
A.![]()
B.![]()
C.y、z的非金屬性依次減弱,所以途徑Ⅱ的熱量按y、z的順序依次增多
D.途徑Ⅰ生成y的氫化物比生成z的氫化物更容易
![]() 元素的某種含氧酸是一種新型氧化劑,應用性極強,通過反應:
元素的某種含氧酸是一種新型氧化劑,應用性極強,通過反應:![]() 制得.該反應中水的作用與下列中水的作用相同的是 ______ 。
制得.該反應中水的作用與下列中水的作用相同的是 ______ 。
A.鈉與水反應制氫氣 ![]() 過氧化鈉與水反應制氧氣
過氧化鈉與水反應制氧氣
C.氯氣與水反應制次氯酸 ![]() 氟單質與水反應制氧氣
氟單質與水反應制氧氣
![]() ,f的最高價氧化物的水化物的
,f的最高價氧化物的水化物的![]() ,使含
,使含![]() 的離子的溶液開始產生沉淀的pH為 ______ 。
的離子的溶液開始產生沉淀的pH為 ______ 。
![]() 元素e和g組成的簡單化合物B的水溶液中離子濃度由大到小的順序為 ______ 。
元素e和g組成的簡單化合物B的水溶液中離子濃度由大到小的順序為 ______ 。
【答案】![]()
![]()
![]() C D 3
C D 3 ![]()
【解析】
從圖中的化合價、原子半徑的大小及原子序數,可知a是H元素,b是C元素,c是N元素,d是O元素,y是F元素,e是Na元素,f是Al元素,g是S元素,z是Cl元素,據此來分析題目即可。
![]() 電子層結構相同的離子,核電荷數越大離子半徑越小,故離子半徑:
電子層結構相同的離子,核電荷數越大離子半徑越小,故離子半徑:![]() ,因此半徑最大的是
,因此半徑最大的是![]() ;
;
![]() 工業上電解食鹽水生成氫氧化鈉,反應還生成氯氣與氫氣,離子方程式為:
工業上電解食鹽水生成氫氧化鈉,反應還生成氯氣與氫氣,離子方程式為:![]() ;
;
![]() 含f的兩種離子為
含f的兩種離子為![]() 、
、![]() ,二者在溶液中發生雙水解生成
,二者在溶液中發生雙水解生成![]() 沉淀而不能大量共存,反應離子方程式為:
沉淀而不能大量共存,反應離子方程式為:![]() ,
,
![]() 化學鍵斷裂需要吸收能量,則
化學鍵斷裂需要吸收能量,則![]() ,故A正確;
,故A正確;
B.根據蓋斯定律可知:![]() ,故B正確;
,故B正確;
C.F的非金屬性比氯的強,HF更穩定,破壞![]() 化學鍵需要的能量更多,故C錯誤;
化學鍵需要的能量更多,故C錯誤;
D.F的非金屬性比氯的強,氟氣與氫氣化合比氯氣的容易,故D正確.
答案選C;
![]() 通過反應:
通過反應:![]() 制得HOF,該反應中水中O元素化合價升高,水是還原劑;
制得HOF,該反應中水中O元素化合價升高,水是還原劑;
A.鈉與水反應制氫氣中水作氧化劑,故A錯誤;
B.過氧化鈉與水反應制氧氣,水既不是氧化劑也不是還原劑,故B錯誤;
C.氯氣與水反應制次氯酸,水既不是氧化劑也不是還原劑,故C錯誤;
D.氟單質與水反應制氧氣,水是還原劑,故D正確.
答案選D;
![]() 的最高價氧化物的水化物為
的最高價氧化物的水化物為![]() ,
,![]() ,使含
,使含![]() 的離子的溶液開始產生沉淀,則
的離子的溶液開始產生沉淀,則![]() ,則
,則![]() ,則
,則![]() ;
;
![]() 元素e和g組成的簡單化合物B為
元素e和g組成的簡單化合物B為![]() ,溶液中
,溶液中![]() 水解呈堿性,溶液中氫離子源于
水解呈堿性,溶液中氫離子源于![]() 水解、水的電離,則
水解、水的電離,則![]() ,則溶液中離子濃度大小比較:
,則溶液中離子濃度大小比較:![]() 。
。


科目:高中化學 來源: 題型:
【題目】第三周期元素X、Y、Z、W的最高價氧化物溶于水可得四種溶液,![]() 的這四種溶液pH與該元素原子半徑的關系如圖所示。下列說法正確的是
的這四種溶液pH與該元素原子半徑的關系如圖所示。下列說法正確的是![]()

A.簡單離子半徑:![]()
B.Y與W形成的化合物分子可能是非極性分子
C.基態原子的第一電離能:![]()
D.X和Y的最高價氧化物對應的水化物恰好中和時,溶液呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器內發生某氣體體系反應,根據如圖填空。
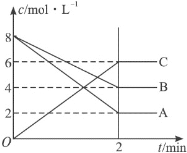
(1)反應物是___,生成物是____。
(2)在2min內A的平均反應速率為___mol·L-1·min-1。
(3)該反應的化學方程式是__![]() ___。
___。
(4)寫出此反應的平衡常數表達式___(用物質A、B、C表示),增大壓強,平衡向___(填“正”或“逆”)反應方向移動,K___(填“增大”、“減小”或“不變”)。
(5)轉化率為已反應的物質的量與初始物質的量比值,B的轉化率為___,若升高溫度,B的轉化率增加,則正反應是___(填“吸熱”或“放熱”)。
(6)2分鐘后的某時刻(t1)改變某一條件使平衡移動,符合如圖所示的條件是___。
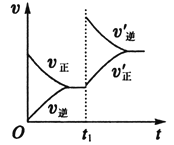
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡元素鐵可形成多種配合物,如:[Fe(CN)6]4- 、Fe(SCN)3 等。
(1)基態鐵原子核外電子排布式為________________.
(2)科學研究表明用 TiO2 作光催化劑可將廢水中 CN- 轉化為OCN-,并最終氧化為 N2 、CO2。OCN- 中三種元素的第一電離能由大到小的順序為_________。
(3)與 CN- 互為等電子體的一種分子為________________(填化學式);1mol Fe(CN)63- 中含有![]() 鍵的數目為________________。
鍵的數目為________________。
(4)鐵的另一種配合物Fe(CO)5 熔點為 —20.5℃,沸點為 103℃,易溶于CCl4,據此可以判斷Fe(CO)5 晶體屬于________________(填晶體類型)。
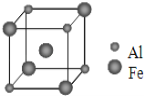
(5)鐵鋁合金的一種晶體屬于體心立方結構,其晶胞可看成由 8 個小體心立方結構堆砌而成。已知小立方體如圖所示,該合金的化學式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、M、W的原子序數依次遞增,X的簡單陰離子與He原子具有相同的電子層結構,Y基態原子未成對電子數在所處周期中最多,M是地殼中含量最多的金屬元素,W原子最外層電子數是K層電子數的3倍,Z、W同主族。
(1)下列說法正確的是______。
A.原子半徑:![]()
B.X、Y、Z三種元素只能形成共價化合物
C.W的簡單氣態氫化物的熱穩定性比Z的強
D.M的單質能溶于W的最高氧化物對應水化物的稀溶液
(2)X、Y、Z、M、W五種元素中:
①電負性最小的元素是______![]() 填元素的符號,下同
填元素的符號,下同![]() ,第一電離能最大的元素是______。
,第一電離能最大的元素是______。
②Z原子的電子排布圖![]() 軌道表示式
軌道表示式![]() 為______,W的電子排布式為______。
為______,W的電子排布式為______。
③如圖可以表示Y單質分子中電子云重疊方式的是______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
1molY單質分子中含有![]() 鍵的數目為______。
鍵的數目為______。
④Y的簡單氣態氫化物極易溶于水,其原因是______;一種含碳元素的陰離子R與Y的簡單氣態氫化物互為等電子體,寫出R的電子式:______。
⑤向W的簡單氣態氫化物的水溶液中通入Z的單質,有W的單質析出,可以驗證Z的非金屬性強于W,該反應的離子方程式為______。
(3)向含有M簡單離子的溶液中加入過量NaOH溶液,可生成![]() 。
。
①不考慮空間構型![]() 要標出配位鍵,M要用元素符號表示
要標出配位鍵,M要用元素符號表示![]() ,
,![]() 的結構可用示意圖表示為______。
的結構可用示意圖表示為______。
②![]() 的空間構型為______,其M原子軌道的雜化類型為______。
的空間構型為______,其M原子軌道的雜化類型為______。
(4)鐵、銅和Y元素可生成晶胞結構圖1所示的化合物,該化合物的化學式為______。
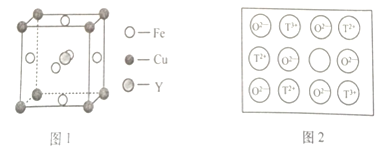
![]() 天然的和絕大部分人工制備的晶體都存在各種缺陷。如某過渡元素T的基態原子中的未成對電子數恰好等于最外層電子數;而其3d能級上的電子數等于最外層電子數的4倍。這種T的氧化物的晶胞結構就存在缺陷
天然的和絕大部分人工制備的晶體都存在各種缺陷。如某過渡元素T的基態原子中的未成對電子數恰好等于最外層電子數;而其3d能級上的電子數等于最外層電子數的4倍。這種T的氧化物的晶胞結構就存在缺陷![]() 如圖2所示
如圖2所示![]() 。
。
①基態![]() 的外圍電子排布式為______;若該T的氧化物晶體中每有1個
的外圍電子排布式為______;若該T的氧化物晶體中每有1個![]() 空缺,則應有______個
空缺,則應有______個![]() 倍
倍![]() 所取代,才能使晶體仍呈電中性。
所取代,才能使晶體仍呈電中性。
②若某T的氧化物晶體樣品中![]() 與
與![]() 的離子數之比為1:11,則該晶體的化學式為______。
的離子數之比為1:11,則該晶體的化學式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為陽離子交換膜法電解飽和食鹽水原理示意圖。下列說法正確的是
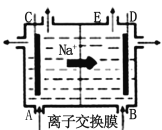
A.從E口逸出的氣體是 Cl2
B.每生成 22.4 L Cl2,同時產生2 mol NaOH
C.從B口加入含少量NaOH的水溶液以增強導電性
D.依次用Na2CO3、NaOH、BaCl2、鹽酸等試劑除去粗鹽水中Ca2+、Mg2+、Fe3+、SO42-等離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關溶液中微粒濃度關系的敘述錯誤的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四種溶液的物質的量濃度大小:①>②>③>④
四種溶液的物質的量濃度大小:①>②>③>④
C.室溫下,![]() 的鹽酸與
的鹽酸與![]() 的氨水等體積混合得溶液中:
的氨水等體積混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,Na2CO3 溶液存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列說法正確的是()
HCO3-+OH-。下列說法正確的是()
A.加入 NaOH 固體,溶液 pH 減小
B.稀釋溶液,水解平衡常數增大
C.升高溫度,![]() 減小
減小
D.加入 CaCl2 固體,平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖回答:

(1)反應物是__________;.
(2)2min內A的平均速率是________;
(3)寫出化學方程式_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com