
【題目】煙道氣的主要成分為粉塵、空氣、H2O、NOx,其中NOx是主要的大氣污染物之一,為了監測某工廠煙道氣中NOx含量,采集標準狀況下50.00 L煙道氣樣經除塵、干燥后緩慢通入適量酸化的H2O2溶液中,使NOx完全被氧化為NO3,除去多余的H2O2并加水稀釋至100.00 mL。量取20.00 mL該溶液,加入30.00 mL 0.01000 mol·L1FeSO4標準溶液(過量),充分反應后,用0.001000 mol·L1 K2Cr2O7標準溶液滴定至終點,消耗K2Cr2O7溶液10.00 mL。滴定過程中發生如下反應:
Fe2+ + NO3 + H+ — NO↑ + Fe3+ + H2O (未配平)
![]() + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化為NO3的離子方程式是_________。
(2)配制100mL 0.001000 mol·L1 K2Cr2O7標準溶液時,除需用到燒杯、量筒、玻璃棒外,還需用到的玻璃儀器有_________、_________。
(3)若FeSO4標準溶液部分變質,會使NOx含量測定結果_________(填“偏高” 、“偏低”或“無影響 ”)。
(4)標準狀況下該工廠煙道氣中NOx(折合成NO2)的含量為_________mg·m3(寫出計算過程)。
【答案】2NO+3H2O2=2H++2NO![]() +2H2O 膠頭滴管 100mL容量瓶 偏高 368 mg·m3
+2H2O 膠頭滴管 100mL容量瓶 偏高 368 mg·m3
【解析】
(1)NO被H2O2氧化為NO3,H2O2被還原為H2O,據此寫出反應的離子方程式;
(2)配制一定濃度的溶液,需用到燒杯、量筒、玻璃棒、膠頭滴管、100mL容量瓶,據此進行解答。
(3)若FeSO4標準溶液部分變質,則消耗K2Cr2O7溶液的體積減小,計算時求得NO3-的物質的量增大,會使NOx含量測定結果偏高;
(4)根據![]() +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O、3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O反應中各量之間的關系進行計算。
+6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O、3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O反應中各量之間的關系進行計算。
(1)NO被H2O2氧化為NO3,H2O2被還原為H2O,反應的離子方程式是2NO+3H2O2=2H++2NO![]() +2H2O;
+2H2O;
答案為:2NO+3H2O2=2H++2NO![]() +2H2O;
+2H2O;
(2)配制100mL 0.001000 mol·L1 K2Cr2O7標準溶液時,除需用到燒杯、量筒、玻璃棒外,還需用到的玻璃儀器有膠頭滴管、100mL容量瓶;
答案為:膠頭滴管、100mL容量瓶;
(3)若FeSO4標準溶液部分變質,則消耗K2Cr2O7溶液的體積減小,計算時求得NO3-的物質的量增大,會使NOx含量測定結果偏高;
答案為:偏高;
(4)根據反應![]() +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O
+6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O
1mol 6mol
5×10-5mol 3×10-4mol
3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O
3mol 1mol
15×10-4mol-3×10-4mol 4×10-4mol
標準狀況下該工廠煙道氣中NOx(折合成NO2)的含量為![]() =368mg·m3;
=368mg·m3;
答案為:368。


科目:高中化學 來源: 題型:
【題目】Ⅰ.工業廢水中含有大量的FeSO4、較多的Cu2+和少量的Na+。從工業廢水中回收硫酸亞鐵和金屬銅的工藝流程如圖所示。
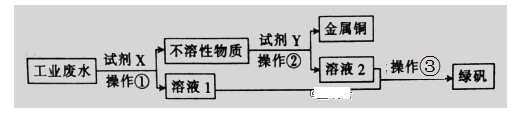
(1)操作③的名稱為__________ 。
(2)試劑X為__________(填化學式),操作②涉及的離子反應方程式為__________ 。
Ⅱ.(3)研究表明:多種海產品如蝦、蟹、牡蠣等,體內含有+5 價砷(As)元素,但它對人體是無毒的,砒霜的成分是 As2O3,屬劇毒物質,專家忠告:吃飯時不要同時大量食用海鮮和青菜,否則容易中毒,并給出了一個公式:大量海鮮+大量維生素 C=砒霜。該使人中毒過程中維生素 C 是________(填“氧化劑”或“還原劑)
(4)已知某反應中反應物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一種未知物X。
①若0.5 molH2C2O4在反應中失去1 mol電子生成X,則X的化學式為__________ 。
②將氧化劑和還原劑及配平的系數填入下列方框中,并用單線橋標出電子轉移的方向和 數目。__________
![]()
③若已知H2C2O4為弱酸,試寫出該反應的離子方程式:__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“共生系統”能很大程度上提高經濟效益。研究硫酸工業尾氣的“共生系統”具有重要意義。回答下列問題:
(1)工業上,將Na2CO3和Na2S以合適的物質的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同時放出CO2。該反應的化學方程式為___________________。
(2)工業上,將富含SO2的工業尾氣降溫液化,收集液態SO2。用液態SO2、硫磺(用S表示)、液氯為原料,在200℃~250℃活性炭催化條件下合成氯化劑SOCl2。該反應中氧化劑與還原劑的物質的量之比為________________。
(3)SOCl2分子的空間構型為______________。下列關于O、S、Se三種同主族元素的敘述正確的是____________(填序號)。
a.沸點:H2O>H2S>H2Se
b.H2O分子中H—O—H鍵的鍵角小于H2S分子中H—S—H鍵的鍵角
c.熱穩定性H2O>H2S>H2Se
d.CS2是一種直線型分子,分子中C、S原子都滿足8電子穩定結構
(4)氯化亞砜(SOCl2,易揮發液體,易水解)常用作脫水劑。ZnCl2·xH2O制取無水ZnCl2流程如圖所示:
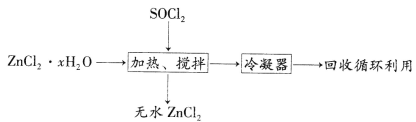
①利用SOCl2和ZnCl2·xH2O混合加熱可制得無水ZnCl2的原因是_________________________________(用化學方程式和必要的文字解釋)。
②甲同學認為SOCl2也可用于FeCl3·6H2O制取無水FeCl3,但乙同學認為該過程會發生氧化還原反應。要驗證乙同學觀點是否正確,可選擇下列試劑中的___________(填序號)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀鹽酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請回答下列問題:
(1)基態Si原子中,電子占據的最高能層符號為___,該能層具有的原子軌道數為___。
(2)BF3與一定量的水形成(H2O)2BF3晶體Q,Q在一定條件下可轉化為R:

晶體Q中各種微粒間的作用力有______(填序號)。
a.離子鍵 b.共價鍵 c.配位鍵 d.氫鍵
(3)第一電離能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶體的原子堆積方式為六方堆積(如圖所示),則晶體中Ti原子的配位數是___,某Ti配合物的化學式是[Ti (H2O)5Cl]Cl2·H2O,1 mol該配合物中含配位鍵的數目是___。
![]()
(5)石墨烯(如圖a)是一種由單層碳原子構成的平面結構新型碳材料,石墨烯中部分碳原子被氧化后,其平面結構會發生改變,轉化為氧化石墨烯(如圖b)。
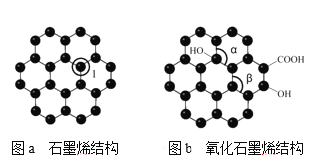
圖a中,1號C與相鄰C形成σ鍵的個數為____,圖b中鍵角α___鍵角β。(填“>”、“<”或“=” );若將圖b所示的氧化石墨烯分散在H2O中,則氧化石墨烯中可與H2O形成氫鍵的原子有_____(填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】探究氫氧化鋁的兩性,最適宜的試劑是( )
A.AlCl3、氨水、稀鹽酸B.![]() 、氨水、稀鹽酸
、氨水、稀鹽酸
C.Al、NaOH溶液、稀鹽酸D.![]() 溶液、NaOH溶液、稀鹽酸
溶液、NaOH溶液、稀鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)( )

A.反應①②③④⑤均屬于氧化還原反應,反應③還屬于置換反應
B.反應⑤說明該條件下鋁可用于制熔點較高的金屬
C.相同條件下生成等量的O2,反應③和④轉移的電子數之比為1∶1
D.反應①中氧化劑與還原劑的物質的量之比為1∶4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種物質有如下變化關系,E是淡黃色粉末,判斷:
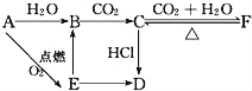
(1)寫出A、B、C、D、E、F的化學式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)寫出有關反應的化學方程式(是離子反應的直接寫離子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以“物質的量”為中心的計算是化學計算的基礎,下列與“物質的量”相關的計算正確的是( )
A. 現有CO、CO2、O3三種氣體,它們分別都含有1 mol O,則三種氣體的物質的量之比為3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子數一定相等
C. 標準狀況下,11.2 L X氣體分子的質量為16 g,則X氣體的摩爾質量是32
D. a g Cl2中有b個氯原子,則阿伏加德羅常數NA的數值可表示為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com